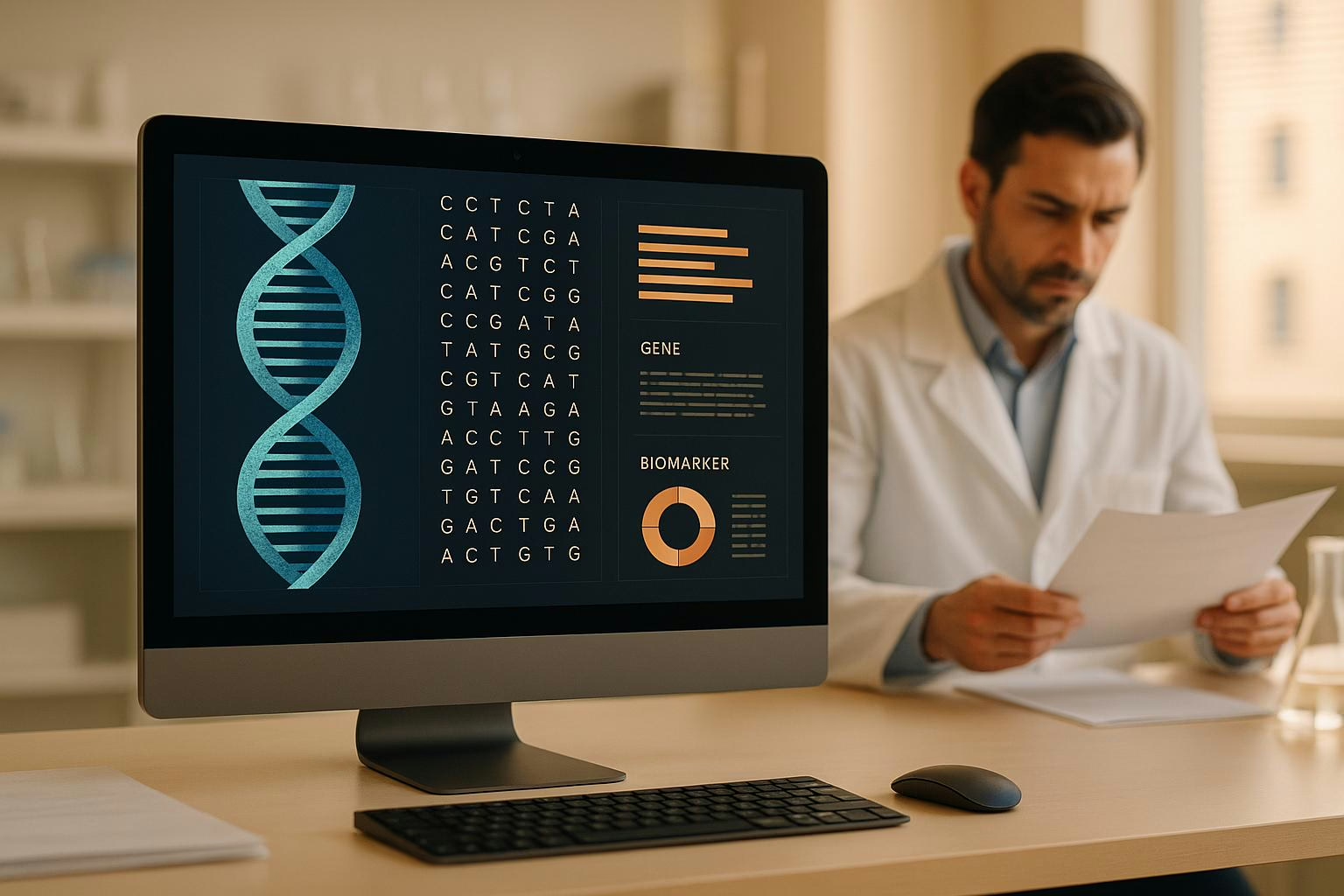
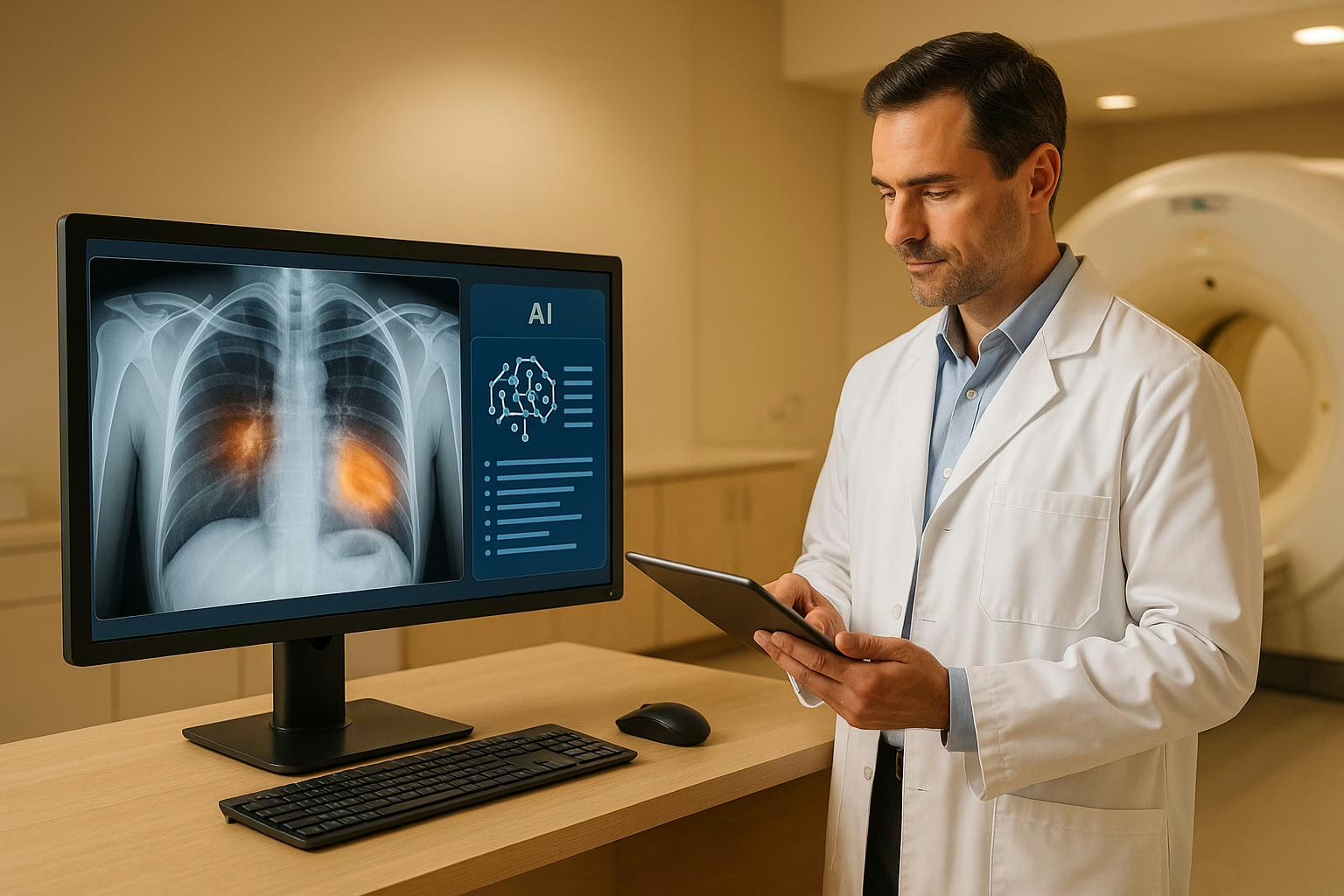
KI-Integration von Genom- und Wearable-Daten
Die Kombination von genomischen, klinischen und Wearable-Daten mithilfe von KI verändert die Medizin grundlegend. Ziel ist es, Gesundheitsdaten aus unterschiedlichen Quellen zusammenzuführen, um Krankheiten besser zu verstehen, präzisere Diagnosen zu stellen und personalisierte Therapien zu ermöglichen. Hier die wichtigsten Punkte auf einen Blick:
- Genomische Daten: Liefert genetische Informationen, die Krankheitsrisiken und Medikamentenreaktionen vorhersagen können.
- Klinische Daten: Umfasst Laborwerte, Bildgebung und Patientenakten, die den Gesundheitszustand detailliert abbilden.
- Wearable-Daten: Stellt kontinuierlich Vitalparameter wie Herzfrequenz und Schlafmuster bereit, um Trends frühzeitig zu erkennen.
- KI-Methoden: Maschinelles Lernen und Natural Language Processing helfen, Muster zu erkennen und unstrukturierte Daten zu verarbeiten.
- Datenschutz: DSGVO-konforme Maßnahmen wie Pseudonymisierung und IT-Sicherheit sind unverzichtbar.
Die Integration dieser Daten eröffnet neue Möglichkeiten für personalisierte Medizin, effizientere Abläufe und bessere Patientenversorgung. Gleichzeitig müssen ethische und rechtliche Herausforderungen gemeistert werden, um Vertrauen und Sicherheit zu gewährleisten.
Pfizer: Implementing Digital Sensor and Wearable Devices in Clinical Trials
Arten von Gesundheitsdaten: Genomische, klinische und Wearable-Daten
Die Nutzung von KI im Gesundheitswesen basiert auf drei Hauptkategorien von Daten, die zusammen ein umfassendes Bild der Patientengesundheit zeichnen. Jede dieser Kategorien hat ihre eigenen Merkmale und spielt eine spezifische Rolle in der medizinischen Analyse. Ein klares Verständnis dieser Datenarten ist entscheidend, um das Potenzial von KI in der Medizin voll auszuschöpfen.
Genomische Daten
Genomische Daten bilden die Grundlage eines individuellen Gesundheitsprofils, da sie die genetische Struktur eines Menschen widerspiegeln. Sie enthalten Informationen über DNA-Sequenzen, Mutationen und genetische Variationen. Dank moderner und erschwinglicher Sequenzierungstechnologien sind diese Daten heute ein fester Bestandteil der klinischen Praxis.
Diese Daten helfen, Krankheitsrisiken, Medikamentenverträglichkeiten und individuelle Anfälligkeiten zu identifizieren. Zum Beispiel können sie erklären, warum manche Menschen für bestimmte Krankheiten empfänglicher sind oder unterschiedlich auf Therapien reagieren. Solche Erkenntnisse sind besonders nützlich für die Entwicklung maßgeschneiderter Behandlungsansätze.
Ein bemerkenswerter Vorteil genomischer Daten ist ihre Beständigkeit: Sie ändern sich im Laufe des Lebens nicht. Diese Stabilität macht sie zu einem zuverlässigen Referenzpunkt, den KI-Systeme nutzen können, um langfristige Gesundheitsprognosen zu erstellen.
Klinische Daten
Klinische Daten stammen aus verschiedenen Quellen wie elektronischen Patientenakten (EPA), Laborergebnissen, bildgebenden Verfahren und ärztlichen Berichten. Sie bieten einen detaillierten Einblick in den Gesundheitszustand, den Verlauf von Krankheiten und die Ergebnisse von Behandlungen.
Laborwerte wie Blutzucker oder Cholesterin liefern präzise Informationen über den Zustand verschiedener Organsysteme. Bildgebende Verfahren wie Röntgen, MRT oder CT-Scans ermöglichen es, die inneren Strukturen des Körpers genau zu analysieren. Ergänzt werden diese Daten durch ärztliche Notizen und Diagnosen, die den klinischen Kontext abrunden.
Allerdings sind klinische Daten oft uneinheitlich. Während Laborwerte meist standardisiert vorliegen, können Arztnotizen in unterschiedlichen Formaten oder Sprachen verfasst sein. KI-Systeme müssen daher sowohl strukturierte als auch unstrukturierte Daten verarbeiten können, um präzise Ergebnisse zu liefern.
Wearable-Daten
Wearable-Daten werden durch tragbare Geräte wie Smartwatches, Fitness-Tracker oder medizinische Sensoren erfasst. Sie umfassen Messwerte wie Herzfrequenz, Schlafmuster, körperliche Aktivität, Schrittanzahl und zunehmend auch Parameter wie Blutsauerstoff oder Hauttemperatur.
Der Hauptvorteil dieser Daten liegt in ihrer kontinuierlichen Erfassung. Während klinische Daten oft nur Momentaufnahmen darstellen, zeichnen Wearables rund um die Uhr Vitalparameter und Verhaltensmuster auf. Dadurch können Trends frühzeitig erkannt werden.
Diese kontinuierliche Datensammlung liefert eine enorme Menge an Informationen, die KI-Systeme nutzen können, um Muster und Abweichungen zu identifizieren. Wearable-Daten ermöglichen es zudem, Frühwarnsysteme zu entwickeln, die gesundheitliche Veränderungen wie Herzrhythmusstörungen erkennen, bevor Symptome auftreten. Gleichzeitig unterstützen sie die Überwachung und Anpassung von Behandlungen im Alltag der Patienten.
KI-Methoden für die Datenintegration
Die Integration verschiedener Gesundheitsdatenarten ist eine Herausforderung, die spezialisierte KI-Techniken erfordert. Ziel ist es, komplexe Muster zu erkennen und Daten aus unterschiedlichen Quellen in ein einheitliches Format zu bringen. Dabei spielen Methoden wie maschinelles Lernen und Natural Language Processing (NLP) eine zentrale Rolle, um aus großen Mengen heterogener Gesundheitsdaten relevante Erkenntnisse zu gewinnen.
Maschinelles Lernen: Muster in Daten erkennen
Maschinelles Lernen ist unverzichtbar, wenn es darum geht, in umfangreichen und komplexen Gesundheitsdatensätzen Muster und Zusammenhänge aufzuspüren. Diese Technologie hilft dabei, Daten aus verschiedenen Bereichen wie Genomik, klinischen Studien und Wearables zu integrieren. Durch kontinuierliche Anpassung und Verbesserung der Modelle können präzisere Ergebnisse erzielt werden, die sowohl Diagnosen als auch präventive Maßnahmen unterstützen. Ergänzend dazu erweitert NLP die Möglichkeiten, indem es unstrukturierte Daten effizient analysiert.
Natural Language Processing: Struktur in Texte bringen
Natural Language Processing (NLP) ist besonders nützlich, wenn es um die Verarbeitung unstrukturierter klinischer Texte geht. Mithilfe dieser Technologie lassen sich medizinische Fachbegriffe analysieren und relevante Informationen aus Dokumenten wie Arztbriefen oder Patientenakten extrahieren. Das Ergebnis: Die zuvor unstrukturierten Daten werden in ein maschinenlesbares Format überführt, was eine integrierte und umfassende Analyse ermöglicht.
Datenstandardisierung: Einheitlichkeit schaffen
Nachdem Muster erkannt und unstrukturierte Daten aufbereitet wurden, ist die Standardisierung der nächste Schritt. Unterschiedliche Datenquellen müssen harmonisiert werden, um Kompatibilität sicherzustellen. Das bedeutet, dass Einheiten, Skalen und Formate vereinheitlicht werden. So können genomische, klinische und Wearable-Daten zusammengeführt und effizient ausgewertet werden. Diese Standardisierungsprozesse sind entscheidend für eine erfolgreiche Integration und Analyse durch KI-gestützte Systeme.
Umsetzung der KI-Integration
Die Integration von genomischen, klinischen und Wearable-Daten mithilfe von KI erfordert eine sorgfältige Planung, die sowohl die DSGVO als auch die deutschen Gesundheitsvorschriften berücksichtigt. Im Folgenden wird der praktische Ablauf dieser Implementierung detailliert beschrieben.
Schrittweiser Prozess der Datenintegration
Der erste Schritt besteht darin, die Daten in standardisierten Formaten zu erfassen – etwa genomische Daten in FASTQ oder VCF, klinische Daten aus elektronischen Patientenakten (EPA) und kontinuierliche Wearable-Daten. Eine gründliche Vorverarbeitung ist entscheidend: Datenformate müssen harmonisiert, Sequenzierungsfehler korrigiert und Bewegungsartefakte bereinigt werden. Fehlende Werte können durch statistische Methoden ergänzt oder, falls notwendig, ausgeschlossen werden.
Nach der Vorverarbeitung kommen maschinelle Lernmodelle (ML) zum Einsatz, um Muster in Echtzeit zu analysieren. Ein Beispiel: Wearable-Daten können auf Herzrhythmusstörungen untersucht und mit genetischen Risikofaktoren in Verbindung gebracht werden.
Einhaltung deutscher und EU-Vorschriften
Neben der technischen Umsetzung ist die Einhaltung rechtlicher Vorgaben unverzichtbar. Vor der Nutzung in KI-Systemen müssen Patientendaten entweder pseudonymisiert oder anonymisiert werden. Zudem ist eine klare und informierte Einwilligung der Patienten erforderlich. Falls die Software als Medizinprodukt eingestuft wird, ist eine CE-Kennzeichnung sowie eine vollständige Dokumentation notwendig.
Die IT-Sicherheit spielt eine ebenso zentrale Rolle: Maßnahmen wie AES-256-Verschlüsselung und Zwei-Faktor-Authentifizierung müssen implementiert werden, um den Anforderungen des Bundesamts für Sicherheit in der Informationstechnik (BSI) gerecht zu werden.
KI-Systeme, die medizinische Diagnosen unterstützen, unterliegen der EU-Verordnung 2017/745 (MDR). Besonders genomische Daten erfordern höchste Sicherheitsstandards, da sie unveränderliche und sensible persönliche Informationen enthalten.
Vergleich von Integrationsplattformen
Die Wahl der richtigen Integrationsplattform hat großen Einfluss auf den Erfolg eines Projekts. Die folgende Tabelle zeigt die wichtigsten Kriterien im Vergleich:
| Kriterium | Cloud-basierte Lösung | On-Premise-System | Hybrid-Ansatz |
|---|---|---|---|
| Sicherheit | Hoch durch zertifizierte Anbieter | Sehr hoch durch vollständige Kontrolle | Hoch durch flexible Konfiguration |
| Skalierbarkeit | Sehr hoch dank elastischer Ressourcen | Begrenzte Skalierbarkeit | Gut anpassbar an den Bedarf |
| Kosten | Geringe Anfangsinvestitionen | Hohe Initialkosten | Moderate Anfangs- und Betriebskosten |
| Compliance | Abhängig vom Anbieter | Volle Kontrolle über Datenschutz | Konfigurierbar, je nach Datenart |
| Wartung | Gering (vom Anbieter verwaltet) | Hoher Aufwand durch eigenes IT-Team | Moderat bei geteilter Verantwortung |
Cloud-basierte Lösungen, wie die Amazon HealthLake oder die Google Cloud Healthcare API, bieten schnelle Implementierung und automatische Skalierung. On-Premise-Systeme hingegen garantieren maximale Kontrolle über die Daten und sind besonders in großen Kliniken beliebt. Hybrid-Ansätze kombinieren die Vorteile beider Modelle: Sensible Daten wie genomische Informationen können lokal gespeichert werden, während weniger kritische Daten, etwa von Wearables, in der Cloud verarbeitet werden.
Die Entscheidung für eine Plattform hängt von der Sensitivität der Daten, dem verfügbaren IT-Budget und den regulatorischen Anforderungen ab. Kleinere Praxen profitieren oft von Cloud-Lösungen, während größere Einrichtungen in der Regel auf eigene Infrastruktur setzen.
sbb-itb-49a712f
Praxisanwendungen und Vorteile
Die Verknüpfung von genomischen, klinischen und Wearable-Daten mithilfe von KI verändert die Art und Weise, wie Behandlungen im deutschen Gesundheitswesen durchgeführt werden. Sie verbessert nicht nur die Effizienz, sondern wirkt sich auch positiv auf die Kostenstrukturen aus. Hier ein Blick auf konkrete Anwendungen und deren Nutzen im Alltag.
Personalisierte Medizin und prädiktive Analytik
Die Kombination von Genom- und Vitaldaten durch KI ermöglicht individuelle Therapien, die auf den spezifischen Bedürfnissen der Patienten basieren. Besonders in der Onkologie spielen genomische Analysen eine zentrale Rolle, da sie gezielt Mutationen identifizieren. Wearables unterstützen dabei, den Gesundheitszustand der Patienten kontinuierlich zu überwachen. Mithilfe von KI können Ärzte Therapien besser anpassen und potenzielle Nebenwirkungen frühzeitig erkennen.
Auch bei Herz-Kreislauf-Erkrankungen und Diabetes zeigt sich das Potenzial: Durch die Integration genetischer Marker und kontinuierlicher Vitaldaten lassen sich Risiken präziser einschätzen und Behandlungspläne optimieren.
Effizienzsteigerung und Kostensenkung
KI trägt nicht nur zur Verbesserung der individuellen Behandlung bei, sondern hilft auch, Prozesse im Gesundheitswesen effizienter zu gestalten. Automatisierte Analysen beschleunigen Diagnosen und optimieren den Ressourceneinsatz, was sowohl Zeit als auch Kosten spart.
Die gezielte Auswertung großer Datenmengen verbessert diagnostische Verfahren und reduziert den administrativen Aufwand. In der Medikamentenentwicklung beschleunigt die Nutzung genomischer und klinischer Daten die Suche nach neuen Wirkstoffen. Zudem ermöglicht die vorausschauende Planung von Patientenzahlen und Personalbedarf kürzere Wartezeiten und eine effizientere Nutzung vorhandener Ressourcen.
Herausforderungen und ethische Überlegungen
Trotz der offensichtlichen Vorteile müssen KI-Lösungen stets unter ethischen und rechtlichen Gesichtspunkten betrachtet werden. Genomische und persönliche Gesundheitsdaten sind besonders sensibel und erfordern strenge DSGVO-konforme Sicherheitsmaßnahmen.
Weitere Herausforderungen betreffen die Qualität und Repräsentativität der Daten. Ein Algorithmus, der auf unzureichenden oder verzerrten Daten basiert, kann fehlerhafte Entscheidungen treffen. Auch die Frage der Haftung bei solchen Fehlern ist oft ungeklärt. Eine übermäßige Abhängigkeit von KI-Systemen birgt zudem Risiken, insbesondere wenn die Entscheidungsprozesse der KI für Patienten und Ärzte nicht transparent sind.
Ein weiteres Problem ist die digitale Kluft: Nicht alle Menschen haben denselben Zugang zu modernen Technologien, was Ungleichheiten verstärken könnte. Um Vertrauen aufzubauen und die Akzeptanz zu fördern, sind Transparenz und Aufklärung essenziell.
Die erfolgreiche Einführung von KI im Gesundheitswesen erfordert nicht nur technisches Know-how, sondern auch ein tiefes Verständnis für ethische, rechtliche und soziale Aspekte. Experten wie Dr. Sven Jungmann helfen dabei, diese komplexen Herausforderungen zu meistern und die digitale Transformation verantwortungsvoll zu gestalten.
Zukunftstrends und Empfehlungen
Die Verschmelzung von Genom- und Wearable-Daten mithilfe von KI steckt noch in den Kinderschuhen, doch die kommenden Jahre versprechen eine tiefgreifende Veränderung in der Nutzung von Gesundheitsdaten. Damit diese Fortschritte erfolgreich umgesetzt werden können, braucht es durchdachte Strategien und erfahrene Begleitung. Hier sind einige zentrale Trends und praktische Empfehlungen, die auf den bisherigen Erkenntnissen aufbauen.
Neue Trends in der digitalen Gesundheit
Die digitale Gesundheitslandschaft entwickelt sich rasant weiter und bringt Technologien hervor, die die Nutzung von Daten noch effizienter machen.
Generative KI zeigt bereits heute ihr Potenzial in der klinischen Dokumentation und wird künftig auch in der genomischen Analyse eine zentrale Rolle spielen. Sie kann komplexe genetische Informationen in leicht verständliche Berichte umwandeln und Ärzten helfen, Daten aus Wearables besser zu interpretieren. Besonders spannend ist die Möglichkeit, automatisch Behandlungsempfehlungen auf Basis verschiedener Datenquellen zu erstellen.
Ambient Intelligence bringt das Gesundheitsmonitoring auf ein neues Level. Sensoren in der Umgebung erfassen kontinuierlich Vitaldaten, ohne dass Patienten aktiv Geräte verwenden müssen. Diese Echtzeitdaten ergänzen genomische Profile und ermöglichen eine noch präzisere personalisierte Medizin.
Hospital-at-Home-Programme profitieren zunehmend von der Integration mehrerer Datenquellen. Patienten können zu Hause überwacht werden, während KI-Systeme genomische Risikofaktoren und aktuelle Vitaldaten abgleichen. Bei Auffälligkeiten wird sofort Alarm ausgelöst. Das Ergebnis: weniger Krankenhausaufenthalte und eine verbesserte Behandlungsqualität.
Mit föderierten Lernverfahren lassen sich KI-Modelle trainieren, ohne dass sensible genomische Daten zwischen Institutionen ausgetauscht werden müssen. So entstehen größere und aussagekräftigere Datensätze, während der Datenschutz gewahrt bleibt.
Best Practices für erfolgreiche KI-Integration
Um diese Technologien effektiv einzusetzen, sind klare Handlungsempfehlungen unerlässlich. Hier sind einige Ansätze, die sich bewährt haben:
- Klarer Fokus auf Anwendungsfälle: Starten Sie mit einem spezifischen Ziel, wie der Vorhersage von Medikamentenverträglichkeiten, und erweitern Sie das System schrittweise nach ersten Erfolgen.
- Datenqualität sicherstellen: Nur vollständige und präzise Daten führen zu verlässlichen KI-Ergebnissen. Unvollständige Datensätze können das Vertrauen in das System gefährden.
- Personal schulen: Ärzte und Pflegekräfte müssen verstehen, wie KI-Systeme funktionieren und welche Grenzen sie haben. Nur so können sie die Ergebnisse richtig interpretieren und sinnvoll in die Behandlung einfließen lassen.
- Standards nutzen: Setzen Sie auf bewährte Standards wie FHIR oder GA4GH, um den Datenaustausch zu erleichtern und Insellösungen zu vermeiden.
- Kontinuierliche Überwachung: Algorithmen müssen regelmäßig überprüft und angepasst werden. Veränderungen in Patientenpopulationen oder Behandlungsansätzen können die Leistung der KI beeinträchtigen.
Wert von Expertenbegleitung
Die Unterstützung durch Experten ist, gerade in einem so dynamischen Feld, unverzichtbar. Fachkundige Beratung hilft dabei, Fallstricke zu vermeiden und die richtigen Strategien zu entwickeln. Dr. Sven Jungmann ist ein Beispiel für einen solchen Experten. Mit seinen Vorträgen und Beratungen unterstützt er Organisationen bei der digitalen Transformation im Gesundheitswesen. Sein fundiertes Wissen in KI und digitaler Gesundheit ermöglicht es, maßgeschneiderte Lösungen zu finden.
Besonders wertvoll ist die Kombination aus technischem Fachwissen und praktischer Erfahrung. Experten können dabei helfen, realistische Erwartungen zu setzen, geeignete Technologien auszuwählen und Implementierungsstrategien zu entwickeln, die den individuellen Anforderungen einer Einrichtung gerecht werden.
Ein weiterer Vorteil ist die Vernetzung mit anderen Akteuren im Gesundheitswesen. Durch den Austausch von Best Practices und die Entwicklung gemeinsamer Standards können neue Technologien schneller und risikoärmer eingeführt werden.
Nicht zu vergessen sind die regulatorischen Anforderungen, wie die DSGVO. Experten sorgen dafür, dass KI-Systeme von Anfang an konform entwickelt werden und rechtliche Hürden problemlos gemeistert werden.
Die Zusammenarbeit mit Experten ist eine Investition, die sich langfristig auszahlt. Sie beschleunigt Entwicklungsprozesse, minimiert Fehlerkosten und erhöht die Erfolgschancen bei der Integration komplexer Technologien wie der Genom- und Wearable-Daten. Gerade in diesen Bereichen ist professionelle Unterstützung oft der Schlüssel zum Erfolg.
Fazit: Das Potenzial der KI im Gesundheitswesen
Die Kombination von Genom-, klinischen und Wearable-Daten durch KI verändert die Medizin grundlegend. Diese Technologien eröffnen eine völlig neue Ebene der Patientenversorgung.
Erst durch die intelligente Verknüpfung von genomischen Profilen, kontinuierlichen Daten aus Wearables und klinischen Informationen mit KI-Algorithmen wird personalisierte Medizin Realität. Die Ergebnisse sind beeindruckend: Ärzte können Behandlungen gezielter anpassen, Nebenwirkungen frühzeitig erkennen und Krankheiten verhindern, bevor sie überhaupt ausbrechen. Patienten erleben dadurch bessere Behandlungserfolge und eine gesteigerte Lebensqualität. Gleichzeitig profitieren Gesundheitssysteme durch effizientere Abläufe und niedrigere Kosten.
Doch trotz der bisherigen Fortschritte gibt es noch Hürden zu überwinden. Datenschutz muss gesichert, ethische Fragestellungen geklärt und die technische Infrastruktur stetig verbessert werden.
Der Schlüssel zum Erfolg liegt in einer durchdachten Strategie und der richtigen Expertise. Wie in den Best Practices gezeigt, sind klare Konzepte und fundierte Beratung unverzichtbar. Organisationen benötigen nicht nur die passende Technologie, sondern auch das Wissen und die Planung, um diese effektiv einzusetzen.
Die Zukunft der Medizin wird durch den klugen Einsatz von Daten geprägt. Wer heute die richtigen Entscheidungen trifft, kann die Chancen von morgen nutzen. Die Integration von Genom- und Wearable-Daten durch KI könnte der Weg zu einer präziseren, effizienteren und menschlicheren Medizin sein.
FAQs
Wie wird bei der Integration von Genom- und Wearable-Daten der Datenschutz und die DSGVO eingehalten?
Die Integration von Genom- und Wearable-Daten in Gesundheitssysteme verlangt ein hohes Maß an Sorgfalt, insbesondere in Bezug auf Datenschutz und die Einhaltung der DSGVO. Da Gesundheitsdaten zu den sensibelsten Informationen gehören, unterliegen sie besonders strengen gesetzlichen Regelungen.
Wichtige Schutzmaßnahmen umfassen die Anonymisierung und Pseudonymisierung der Daten, um sicherzustellen, dass keine Rückschlüsse auf einzelne Personen möglich sind. Ebenso wichtig sind eine klare und verständliche Information der Betroffenen, ihre ausdrückliche Zustimmung zur Datennutzung sowie der Einsatz technischer und organisatorischer Sicherheitsvorkehrungen wie Verschlüsselung und Zugriffsbeschränkungen.
Die Einhaltung der DSGVO ist nicht nur eine rechtliche Verpflichtung, sondern auch eine zentrale Voraussetzung, um das Vertrauen der Patienten zu gewinnen und die Rechte aller Beteiligten effektiv zu wahren.
Welche Hindernisse gibt es bei der Nutzung von KI zur Integration von Genom-, klinischen und Wearable-Daten, und wie lassen sich diese lösen?
Die Integration von Genom-, klinischen und Wearable-Daten in Gesundheitssysteme ist keine leichte Aufgabe. Zu den größten Hürden gehören der Schutz sensibler Daten, fehlende Standards für die Interoperabilität und hohe Kosten, die insbesondere in einkommensschwachen oder abgelegenen Regionen den Zugang erschweren.
Technologien wie Federated Learning könnten hier eine wichtige Rolle spielen, da sie Datenschutz gewährleisten, während sie gleichzeitig den Austausch von Informationen ermöglichen. Doch technische Lösungen allein reichen nicht aus. Eine enge Zusammenarbeit zwischen Technologie-Expertinnen und Experten, medizinischem Fachpersonal und politischen Entscheidungsträgern ist essenziell, um praktikable und gerechte Ansätze zu entwickeln. Dabei müssen nicht nur ethische Fragen wie Datenbesitz und Verantwortlichkeiten geklärt werden, sondern auch Programme geschaffen werden, die Patienten dabei unterstützen, digitale Kompetenzen zu erlangen. Nur so können langfristig alle Beteiligten von diesen Innovationen profitieren.
Wie verbessert die Kombination von Genom- und Wearable-Daten die personalisierte Medizin und die Patientenversorgung?
Die Verbindung von Genomdaten und Informationen aus Wearables verändert die personalisierte Medizin grundlegend. Sie ermöglicht es, Gesundheitsversorgung genauer und früher auf die individuellen Bedürfnisse abzustimmen. Genomdaten geben Aufschluss über genetische Veranlagungen und das Risiko für bestimmte Erkrankungen. Wearables wiederum liefern kontinuierlich Echtzeitdaten, wie Herzfrequenz, Schlafmuster oder Aktivitätsniveau.
Indem diese beiden Datenquellen kombiniert werden, können Ärzt_innen Behandlungspläne erstellen, die sowohl das genetische Profil als auch den aktuellen Gesundheitszustand berücksichtigen. Das Ergebnis: präzisere Diagnosen, gezieltere Therapien und eine spürbare Verbesserung der Lebensqualität der Patient_innen.
Verwandte Blogbeiträge
- KI im Gesundheitswesen: 7 praktische Anwendungen
- Daten-Mapping und Transformation mit KI
- KI in Wearables: Anomalien erkennen
- Die Rolle von KI in der Personalisierung digitaler Gesundheitsplattformen
DSGVO vs. HIPAA: Unterschiede bei Telemedizin
DSGVO und HIPAA regeln den Schutz von Patientendaten unterschiedlich. Die DSGVO schützt alle personenbezogenen Daten von EU-Bürgern, während HIPAA sich auf Gesundheitsdaten (PHI) in den USA konzentriert. Beide Vorschriften setzen hohe Sicherheitsstandards, unterscheiden sich jedoch in ihrem Anwendungsbereich, den Begrifflichkeiten und den Strafen bei Verstößen.
Die wichtigsten Punkte im Überblick:
- Datenabdeckung: DSGVO umfasst alle personenbezogenen Daten, HIPAA nur Gesundheitsinformationen (PHI).
- Geografische Reichweite: DSGVO gilt weltweit für EU-Daten, HIPAA für US-Gesundheitsdaten.
- Strafen: DSGVO: bis zu 20 Mio. € oder 4 % des Jahresumsatzes. HIPAA: bis zu 1,5 Mio. US-$ pro Kategorie/Jahr.
- Patientenrechte: DSGVO bietet umfassendere Rechte wie Datenübertragbarkeit und Löschung.
- Compliance-Anforderungen: DSGVO verlangt Datenschutz-Folgenabschätzungen, HIPAA regelmäßige Risikobewertungen.
Quick Comparison:
| Aspekt | DSGVO | HIPAA |
|---|---|---|
| Datenabdeckung | Alle personenbezogenen Daten | Geschützte Gesundheitsinformationen (PHI) |
| Geografische Geltung | Weltweit für EU-Daten | USA, bei Zusammenarbeit mit US-Einrichtungen |
| Patientenrechte | Umfassender, inkl. Datenübertragbarkeit | Begrenzter, Fokus auf Gesundheitsdaten |
| Maximale Strafe | Bis zu 20 Mio. € oder 4 % Umsatz | Bis zu 1,5 Mio. US-$ pro Kategorie/Jahr |
| Sicherheitsmaßnahmen | Privacy by Design | Fokus auf elektronische Gesundheitsdaten (ePHI) |
Unternehmen in der Telemedizin müssen beide Regelwerke beachten, wenn sie sowohl EU- als auch US-Patienten betreuen. Das erfordert getrennte Datenverarbeitungsprozesse und angepasste Sicherheitsmaßnahmen.
Anwendungsbereich und Geltung in der Telemedizin
Datenarten und Abdeckung
HIPAA schützt ausschließlich Protected Health Information (PHI) – also identifizierbare Gesundheitsdaten, die persönliche Identifikatoren wie Name, Geburtsdatum oder Sozialversicherungsnummer enthalten [1] [3]. Im Gegensatz dazu deckt die DSGVO alle personenbezogenen Daten ab, die sich auf eine identifizierbare natürliche Person beziehen. Gesundheitsdaten fallen hier unter „besondere Kategorien“ und genießen einen höheren Schutz [1].
Für Anbieter in der Telemedizin ergeben sich daraus wesentliche Unterschiede: Während HIPAA sich strikt auf Gesundheitsinformationen beschränkt [1], umfasst die DSGVO zusätzlich Daten wie Namen, Adressen, Bankverbindungen oder biometrische Merkmale [1]. Beide Regelwerke verlangen jedoch, dass medizinische Daten wie Patientenakten, Verschreibungen oder Informationen aus Videoanrufen besonders gesichert werden [2].
Auch die Terminologie der beiden Regelwerke unterscheidet sich deutlich. HIPAA verwendet Begriffe wie „Individuen“ für Dateneigentümer und „Nutzung und Offenlegung“ für den Umgang mit PHI [1]. Die DSGVO spricht hingegen von „betroffenen Personen“ und nutzt den breiteren Begriff „Verarbeitung“, der alle Arten von Datenaktionen abdeckt [1].
Diese Unterschiede beeinflussen nicht nur die Definitionen, sondern auch die geografische Reichweite der Regelungen.
Geografische Reichweite der Regelungen
HIPAA gilt in erster Linie für Covered Entities und deren Business Associates mit Sitz in den USA [4]. Für internationale Unternehmen wird HIPAA dann relevant, wenn sie US-Patienten behandeln oder mit US-Gesundheitseinrichtungen kooperieren [4].
Die DSGVO hat eine weiterreichende Anwendung: Sie gilt weltweit für Unternehmen, die personenbezogene Daten von EU-Bürgern verarbeiten – unabhängig davon, wo das Unternehmen ansässig ist [2].
Diese unterschiedlichen Geltungsbereiche können für Telemedizin-Anbieter zu Herausforderungen führen. Unternehmen, die sowohl US-amerikanische als auch europäische Patienten betreuen, müssen gleichzeitig die Anforderungen von HIPAA und DSGVO erfüllen. Das bedeutet oft, dass separate Datenschutzrichtlinien, unterschiedliche Einwilligungsverfahren und angepasste technische Sicherheitsmaßnahmen für die verschiedenen Patientengruppen erforderlich sind.
Die HIPAA Privacy Rule findet gleichermaßen Anwendung auf persönliche und digitale Gesundheitsdienstleistungen, einschließlich Telemedizin. Bestehende Regeln gelten automatisch auch für Telehealth-Aktivitäten [3]. Zusätzlich konzentriert sich die Security Rule speziell auf elektronische Gesundheitsdaten (ePHI), was sie besonders relevant für digitale Telemedizin-Plattformen macht [1].
Kernpflichten für die Compliance in der Telemedizin
Sicherheitsanforderungen
Die Sicherheitsanforderungen im Bereich der Telemedizin unterscheiden sich deutlich zwischen HIPAA und der DSGVO. Während HIPAA speziell den Schutz von PHI (Protected Health Information) regelt, umfasst die DSGVO sämtliche personenbezogenen Daten von EU-Bürgern, einschließlich Gesundheitsdaten, die als besonders sensibel gelten [5][6]. Ein zentraler Aspekt der DSGVO ist das Prinzip „Privacy by Design“, das verlangt, Datenschutz bereits in der Entwicklungsphase von Telemedizin-Plattformen zu berücksichtigen. Diese Vorgaben bilden die Basis für wichtige Regelungen zu Einwilligung und Autorisierung.
Einwilligung und Autorisierung
Neben technischen Sicherheitsmaßnahmen spielen auch die Prozesse rund um Einwilligung und Autorisierung eine entscheidende Rolle. Die DSGVO schreibt vor, dass Patienten ihre ausdrückliche und informierte Zustimmung zur Verarbeitung ihrer Daten geben müssen [2]. HIPAA hingegen gewährt Patienten umfassende Rechte, einschließlich der Möglichkeit, zuvor erteilte Autorisierungen zu widerrufen [7].
Patientenrechte
Im Hinblick auf Patientenrechte bietet HIPAA Regelungen wie den Zugang zu Daten, deren Berichtigung sowie Informationen über Weitergaben [7]. Die DSGVO geht darüber hinaus und ergänzt diese Rechte um zusätzliche Ansprüche, darunter das Recht auf Auskunft, Löschung, Einschränkung der Verarbeitung, Datenübertragbarkeit und Widerspruch [2].
What Are The Vague HIPAA Regulations For Telehealth Compliance? - Telehealth Care Expert
sbb-itb-49a712f
Strafen, Durchsetzung und Risikomanagement
Die Einhaltung von Sicherheits- und Einwilligungsverfahren wird streng überwacht, und auch die Durchsetzung der Vorschriften unterliegt einer genauen Kontrolle.
Strafstrukturen
Die Bußgeldregelungen der DSGVO und HIPAA unterscheiden sich sowohl in der Höhe als auch in der Berechnungsweise. Nach der DSGVO können Strafen bis zu 20 Mio. € oder 4 % des weltweiten Jahresumsatzes betragen – je nachdem, welcher Betrag höher ist. HIPAA hingegen nutzt ein gestuftes System, das abhängig vom Grad der Fahrlässigkeit ist. Strafen reichen hier von 100 US‑$ bis zu 50.000 US‑$ pro Verstoß, mit einer jährlichen Obergrenze von 1,5 Mio. US‑$ pro Verstoßkategorie.
| Aspekt | DSGVO | HIPAA |
|---|---|---|
| Maximale Strafe | 20 Mio. € oder 4 % des Jahresumsatzes | 1,5 Mio. US‑$ pro Kategorie/Jahr |
| Berechnungsgrundlage | Weltweiter Jahresumsatz | Pro Verletzung und Kategorie |
| Durchsetzungsbehörde | Nationale Datenschutzbehörden | HHS Office for Civil Rights |
| Verjährungsfrist | Variiert je nach Mitgliedstaat | 6 Jahre |
Für Telemedizin-Anbieter, die grenzüberschreitend tätig sind, entsteht ein besonders hohes Risiko. Ein deutscher Anbieter, der auch US-amerikanische Patienten betreut, muss sowohl die DSGVO als auch HIPAA vollständig einhalten. Im Falle eines Verstoßes könnten Sanktionen von beiden Seiten drohen.
Audits und Risikobewertungen
Regelmäßige Audits und Risikobewertungen sind unverzichtbar, um in der Telemedizin Compliance sicherzustellen. Die DSGVO schreibt beispielsweise eine Datenschutz-Folgenabschätzung (DSFA) vor, wenn Verarbeitungsvorgänge ein hohes Risiko für die Rechte und Freiheiten natürlicher Personen bergen. Dies trifft häufig auf Telemedizin-Anwendungen zu, da hier sensible Gesundheitsdaten verarbeitet werden.
HIPAA verlangt ebenfalls eine umfassende Risikobewertung für alle Systeme, die geschützte Gesundheitsinformationen (PHI) verarbeiten, speichern oder übertragen. Diese Bewertungen müssen dokumentiert und regelmäßig aktualisiert werden. Besonders wichtig für Telemedizin-Anbieter ist die Sicherheit von Videokonferenz-Plattformen, Cloud-Speicherdiensten und mobilen Anwendungen.
Empfohlene Maßnahmen:
- Erstellen Sie eine detaillierte Übersicht aller Datenflüsse – von der Registrierung über die Konsultation bis hin zur Abrechnung.
- Identifizieren und beheben Sie Schwachstellen durch gezielte Schutzmaßnahmen.
- Setzen Sie ein kontinuierliches Monitoringsystem ein, um Anomalien frühzeitig zu erkennen.
- Dokumentieren Sie alle Verarbeitungsprozesse und Sicherheitsmaßnahmen lückenlos.
Diese Schritte ergänzen die Sicherheits- und Einwilligungsanforderungen und bilden die Grundlage für eine robuste Compliance-Strategie.
Praktische Empfehlungen für Telemedizin-Anbieter
DSGVO und HIPAA stellen klare Anforderungen: Plattformen und Prozesse müssen so gestaltet sein, dass sie beiden Regelwerken gerecht werden.
Verwaltung der dualen Compliance
Telemedizin-Anbieter, die in Deutschland und den USA aktiv sind, bewegen sich in einem komplexen rechtlichen Umfeld. Besonders die Übertragung personenbezogener Daten zwischen Ländern stellt eine Herausforderung dar. Während die DSGVO den Schutz dieser Daten bei der Verarbeitung außerhalb der EU betont, legt HIPAA den Fokus auf strenge Sicherheitsstandards.
Ein bewährtes Konzept ist die Nutzung regionaler Datensilos. Europäische Patientendaten sollten ausschließlich in Rechenzentren innerhalb der EU verarbeitet werden, während US-Daten in HIPAA-konformen Einrichtungen verbleiben. Diese Trennung hilft, lokale Vorschriften einzuhalten und Risiken durch grenzüberschreitende Datenschutzverletzungen zu minimieren. Sie bildet auch die Grundlage für technische Sicherheitsmaßnahmen.
Cloud-Anbieter bieten oft Programme an, die sowohl die DSGVO als auch HIPAA berücksichtigen. Wichtige Dokumente wie der Business Associate Agreement (BAA) für HIPAA und der Auftragsverarbeitungsvertrag (AVV) für die DSGVO definieren dabei die notwendigen Sicherheitsvorkehrungen.
Darüber hinaus ist die Interoperabilität der Systeme entscheidend. Telemedizin-Plattformen sollten den sicheren Datenaustausch zwischen verschiedenen Systemen ermöglichen – idealerweise mit standardisierten APIs, die Verschlüsselung und granulare Zugriffskontrollen integrieren. Nach der strategischen Planung ist der Aufbau robuster technischer Schutzmaßnahmen der nächste Schritt.
Sicherheits-Best-Practices
Neben der strategischen Planung sind technische Maßnahmen unverzichtbar. Moderne Telemedizin-Plattformen setzen auf mehrschichtige Sicherheitskonzepte, die über die Mindestanforderungen hinausgehen. Eine rollenbasierte Zugriffskontrolle (RBAC) sorgt dafür, dass nur autorisierte Personen – wie Ärzte, Pflegekräfte oder Administratoren – Zugang zu den für sie relevanten Daten haben.
Fortschrittliche Verschlüsselungstechnologien wie AES-256 und PFS sowie Zero-Trust-Architekturen mit Multi-Faktor-Authentifizierung bieten zusätzlichen Schutz. HIPAA empfiehlt den Einsatz robuster Verschlüsselung, während die DSGVO verlangt, stets den aktuellen Stand der Technik anzuwenden. Jeder Zugriff wird als potenziell unsicher betrachtet und muss entsprechend authentifiziert und autorisiert werden.
Zusätzlich können Technologien wie Blockchain eine transparente Verwaltung von Einwilligungen ermöglichen. Patienten können damit detailliert nachvollziehen, wer auf ihre Daten zugegriffen hat, und ihre Einwilligungen flexibel verwalten.
Incident-Response-Pläne müssen die unterschiedlichen Anforderungen der DSGVO und HIPAA berücksichtigen. Während die DSGVO eine Meldung an die Aufsichtsbehörde innerhalb von 72 Stunden vorschreibt, verlangt HIPAA, dass betroffene Personen innerhalb von 60 Tagen informiert werden. Automatisierte Systeme können helfen, im Falle eines Vorfalls schnell die notwendigen Schritte einzuleiten.
Diese Maßnahmen erfüllen nicht nur die Compliance-Anforderungen, sondern stärken auch das Vertrauen von Patienten und Partnern in die Sicherheit der Telemedizin-Plattformen. Die Kombination aus strategischer Planung und technischer Umsetzung bildet eine solide Basis für eine umfassende Compliance-Strategie.
Fazit: Wichtige Erkenntnisse für digitale Gesundheitsinnovationen
Die Unterschiede zwischen DSGVO und HIPAA spielen eine entscheidende Rolle bei der Entwicklung der Telemedizin in Europa und den USA. Während die DSGVO einen breiten Schutz personenbezogener Daten bietet und Patienten umfangreiche Kontrollrechte einräumt, legt HIPAA den Fokus speziell auf Gesundheitsdaten und verlangt von Leistungserbringern strenge Sicherheitsmaßnahmen.
Diese unterschiedlichen regulatorischen Ansätze führen dazu, dass praxisorientierte Lösungen entwickelt werden, die den Weg für nachhaltige Fortschritte bereiten. Plattformen, die sowohl DSGVO- als auch HIPAA-konform sind, genießen ein hohes Maß an Vertrauen von Patienten und Partnern.
Regulatorische Vorgaben treiben Innovation voran. Neue Sicherheitskonzepte entstehen oft als direkte Antwort auf diese Anforderungen und fördern die digitale Transformation. Am Ende profitieren alle Nutzer von diesen Entwicklungen, da sie zu stabileren und sichereren Gesundheitssystemen beitragen.
Für Akteure im deutschen Gesundheitswesen bedeutet das konkret: Compliance ist ein klarer Wettbewerbsvorteil. Die Fähigkeit, regulatorische Anforderungen zu erfüllen, stärkt nicht nur das Vertrauen, sondern auch die Innovationskraft. Experten wie Dr. Sven Jungmann, mit seiner Erfahrung in den Bereichen künstliche Intelligenz, digitale Gesundheit und Innovation, können Organisationen dabei helfen, diese Herausforderungen zu meistern und die digitale Transformation erfolgreich voranzutreiben.
FAQs
Wie können Telemedizin-Anbieter sicherstellen, dass sie sowohl die DSGVO- als auch die HIPAA-Vorgaben erfüllen?
Um die Anforderungen sowohl der DSGVO als auch der HIPAA zu erfüllen, müssen Telemedizin-Anbieter auf sichere technische und organisatorische Maßnahmen setzen. Dazu zählen unter anderem Zugriffsbeschränkungen, Datenverschlüsselung und Audit-Protokolle, die den Schutz elektronischer Gesundheitsdaten (ePHI) gewährleisten.
Ein weiterer zentraler Punkt ist die Einholung der Zustimmung der Patienten. Es dürfen ausschließlich die Daten erhoben werden, die für die Behandlung wirklich notwendig sind. Die DSGVO betont zudem das Recht der Patienten auf Auskunft, Berichtigung und Löschung ihrer Daten. Klare Kommunikation und transparente Datenschutzrichtlinien sind hierbei entscheidend, um Vertrauen zu schaffen und den Vorgaben beider Regelwerke gerecht zu werden.
Regelmäßige Überprüfungen der internen Prozesse sowie Schulungen für alle Mitarbeitenden sind essenziell, um eine dauerhafte Konformität sicherzustellen.
Welche Sicherheitsmaßnahmen sind erforderlich, damit Telemedizin-Plattformen die DSGVO- und HIPAA-Vorgaben einhalten?
Um sowohl die DSGVO- als auch die HIPAA-Anforderungen zu erfüllen, müssen Telemedizin-Plattformen strenge Sicherheitsvorkehrungen treffen. Ein zentraler Punkt ist die End-to-End-Verschlüsselung, die sicherstellt, dass sensible Daten sowohl bei der Übertragung als auch bei der Speicherung geschützt sind. Hierbei sollte mindestens der AES-256-Standard verwendet werden, um ein hohes Sicherheitsniveau zu gewährleisten.
Ebenso wichtig ist eine sichere Authentifizierung, die starke Passwörter und eine Multi-Faktor-Authentifizierung (MFA) umfasst. Diese Maßnahmen verhindern unbefugten Zugriff auf sensible Informationen. Zusätzlich sollten alle Zugriffe auf Patientendaten durch Audit-Protokolle dokumentiert werden, um Transparenz zu schaffen und die Nachverfolgbarkeit sicherzustellen.
Ein weiterer wichtiger Aspekt ist, dass Plattformanbieter ein Business Associate Agreement (BAA) abschließen müssen. Dieses Abkommen bestätigt ihre Verpflichtung, die HIPAA-Vorgaben bei der Verarbeitung von Patientendaten einzuhalten. Egal, ob die Daten in der Cloud oder lokal gespeichert werden, ihre sichere Speicherung ist unerlässlich, um den gesetzlichen Anforderungen gerecht zu werden.
Welche Datenschutzanforderungen müssen Telemedizin-Unternehmen beachten, die in der EU und den USA tätig sind?
Telemedizin-Unternehmen, die sowohl in der EU als auch in den USA tätig sind, stehen vor einer anspruchsvollen Aufgabe: Sie müssen gleichzeitig die Datenschutz-Grundverordnung (DSGVO) der EU und den Health Insurance Portability and Accountability Act (HIPAA) der USA einhalten. Beide Regelwerke verfolgen unterschiedliche Ansätze und haben spezifische Vorgaben, die Unternehmen beachten müssen.
Die DSGVO regelt den Umgang mit einer Vielzahl personenbezogener Daten und legt besonderen Wert auf Transparenz sowie die Rechte der betroffenen Personen. Im Gegensatz dazu konzentriert sich HIPAA ausschließlich auf den Schutz von Gesundheitsdaten in den USA und schreibt dafür äußerst strikte Sicherheitsmaßnahmen vor. Wichtig zu wissen: Die Einhaltung der DSGVO bedeutet nicht automatisch, dass auch die HIPAA-Anforderungen erfüllt sind, da HIPAA in einigen Bereichen detailliertere Bestimmungen vorgibt.
Für eine sichere Übertragung von Gesundheitsdaten zwischen der EU und den USA müssen Unternehmen die Anforderungen beider Regelwerke genau kennen und umsetzen. Nur so können sie sicherstellen, dass sie sowohl den europäischen als auch den amerikanischen Vorschriften gerecht werden und rechtliche Risiken vermeiden. Eine sorgfältige Planung und fundiertes Wissen über beide Gesetze sind dabei unerlässlich.
Verwandte Blogbeiträge
- Digitale Transformation erfolgreich umsetzen
- Technologie-Trends 2025: Der komplette Guide
- Medizinische Wearables: EU vs. US-Regulierungen
- FHIR und Interoperabilität: Standards im Fokus
Top-Strategien für Führung in der digitalen Gesundheit
Die digitale Transformation im Gesundheitswesen erfordert neue Ansätze für Führungskräfte. Deutschland hinkt im Vergleich zu Ländern wie Estland hinterher, was den Einsatz digitaler Technologien angeht. Um diesen Rückstand aufzuholen, müssen Führungskräfte:
- Mitarbeiter stärken: Wohlbefinden fördern, digitale Kompetenzen ausbauen und kontinuierliches Lernen ermöglichen.
- Abteilungen vernetzen: Zusammenarbeit und klare Strukturen für digitale Projekte schaffen.
- Künstliche Intelligenz nutzen: Effizientere Entscheidungen durch datenbasierte Ansätze treffen.
- Vielfalt fördern: Alle Perspektiven einbinden und psychologische Sicherheit gewährleisten.
- Kommunikation verbessern: Transparente und zielgruppengerechte Informationen bereitstellen.
- Investitionen planen: Langfristige finanzielle Planung und Nutzenbewertung.
- IT-Infrastruktur modernisieren: Skalierbare, sichere und vernetzte Systeme implementieren.
Diese Strategien kombinieren technisches Wissen mit Führungskompetenz, um die digitale Gesundheit nachhaltig zu gestalten.
E-Health im Aufbruch: Dorit Posdorf über Führung, Digitalisierung und DocMorris
1. Mitarbeiterwohlbefinden und kontinuierliches Lernen priorisieren
Der Erfolg der digitalen Transformation steht und fällt mit der Akzeptanz und den Fähigkeiten der Mitarbeitenden. Führungskräfte, die ihre Teams durch diesen Wandel begleiten wollen, müssen das Wohlbefinden ihrer Angestellten in den Fokus rücken und gleichzeitig Möglichkeiten für kontinuierliches Lernen schaffen. Ein zentraler Ansatzpunkt ist die Einführung partizipativer Entwicklungsprozesse.
Partizipative Entwicklungsprozesse spielen eine Schlüsselrolle. Gesundheitsfachkräfte sollten als Endnutzer aktiv in die Entwicklung und Bewertung digitaler Systeme eingebunden werden. Ein Beispiel dafür ist der E-Health-Monitor in den Niederlanden. Dieser sammelt jährlich Daten zur Nutzung von E-Health-Angeboten und bezieht die Endnutzer aktiv ein.
"Such participatory processes contribute significantly to user satisfaction." - Bertelsmann Stiftung, Analyse von fünf Vorreiternationen im Bereich digitaler Gesundheitsstrategien [1]
Die gezielte Entwicklung digitaler Kompetenzen ist ein weiterer wichtiger Schritt. Dazu gehört, bestehende Kompetenzlücken zu identifizieren und maßgeschneiderte Weiterbildungsmöglichkeiten zu schaffen. Projektbasiertes Lernen und der Austausch von Wissen im Team können dabei besonders effektiv sein.
"Digital Leader:innen befähigen ihre Mitarbeitenden, selbstständig im digitalen Kontext zu agieren. Sie sorgen für die notwendigen Rahmenbedingungen, schaffen Zugänge zu Technologien und Wissen und unterstützen ihre Teams dabei, digitale Kompetenzen aufzubauen." [5]
Flexible Lernformate sind dabei ein entscheidender Erfolgsfaktor. Kompakte interne Schulungen und sogenannte Leadership Sprints vermitteln technische Fähigkeiten und Soft Skills in kurzen, praxisnahen Modulen. Solche Formate fördern nicht nur den Aufbau von Kompetenzen, sondern auch eine lernorientierte Führungskultur.
Ein weiterer Vorteil der digitalen Transformation ist die Entlastung der Mitarbeitenden durch den Einsatz moderner Technologien. Dies bringt nicht nur spürbare Erleichterung im Arbeitsalltag, sondern bietet auch Lösungen für den Fachkräftemangel [2][3].
Eine Kultur des kontinuierlichen Lernens entsteht, wenn Führungskräfte diese Haltung aktiv vorleben und fördern. Mitarbeitende sollten dazu ermutigt werden, ihr Wissen zu hinterfragen und sich stetig weiterzuentwickeln.
Dr. Sven Jungmann bietet Keynotes und Vorträge zu Themen wie künstliche Intelligenz, Innovation und digitale Gesundheit an. Mit seinen praxisnahen Einblicken in technologische Entwicklungen unterstützt er Organisationen dabei, die digitale Transformation erfolgreich zu gestalten und zu nutzen.
2. Abteilungsübergreifende Zusammenarbeit und Change Management aufbauen
Nachdem die individuellen Kompetenzen gestärkt wurden, ist der nächste Schritt, die Zusammenarbeit zwischen verschiedenen Abteilungen zu fördern. Um digitale Gesundheitsstrategien erfolgreich umzusetzen, braucht es eine enge Abstimmung zwischen allen Beteiligten. Ohne klare Strukturen und ein durchdachtes Change Management können selbst die besten Ideen an organisatorischen Hürden scheitern. Klare Verantwortlichkeiten und gut definierte Prozesse sind daher unverzichtbar.
Klare Verantwortlichkeiten und Governance-Strukturen sind das Rückgrat für bereichsübergreifende Projekte. Führungskräfte sollten Steuerungsgremien einrichten, die Vertreter aus unterschiedlichen Bereichen zusammenbringen. Diese Gremien übernehmen die Koordination, überwachen Fortschritte und fördern den Austausch zwischen allen Beteiligten [1].
Ein Beispiel aus Deutschland verdeutlicht dies: Im Jahr 2023 entwickelte das Bundesgesundheitsministerium seine Digitalisierungsstrategie für Gesundheit und Pflege. Dabei wurden über 500 Personen und Institutionen eingebunden [1]. Dieser Ansatz zeigt, wie wichtig eine breite Abstimmung zwischen Patienten, medizinischen Fachkräften, Pflegeeinrichtungen und anderen Akteuren ist.
Die Zusammenarbeit auf mehreren Ebenen und zwischen verschiedenen Akteuren hat sich als besonders effektiv erwiesen. Eine digitale Gesundheitsstrategie muss europäische, nationale und sektorale Perspektiven berücksichtigen. Das erfordert eine aktive Kooperation zwischen nationalen Akteuren wie der Bundesregierung, Ministerien, Ärztekammern, Krankenkassen und anderen Organisationen [1].
Ein weiterer wichtiger Punkt ist die kontinuierliche Einbindung der Endnutzer. Gesundheitsdienstleister und Patienten sollten aktiv in die Entwicklung und Anpassung digitaler Strategien eingebunden werden. Besonders Gesundheitsfachkräfte spielen hier eine zentrale Rolle, da sie direkt am Point of Service arbeiten und wertvolles Feedback geben können, um die Prozesse patientenorientierter zu gestalten [1][4].
Ein entscheidender Faktor für den Erfolg ist zudem die ausreichende Ressourcenausstattung. Die Institutionen, die für die Umsetzung und das Management von Projekten verantwortlich sind, benötigen von Beginn an genügend personelle und finanzielle Mittel, um effektiv arbeiten zu können [1].
Führungskräfte sollten außerdem präzise Roadmaps mit klaren Zeitplänen und Verantwortlichkeiten entwickeln, um aktuelle und künftige Projekte zu strukturieren. Regelmäßige Monitoring-Systeme helfen dabei, qualitative und quantitative Daten zu sammeln, die Auskunft über die Nutzung und Akzeptanz digitaler Gesundheitsangebote geben [1].
Durch diese partizipative Herangehensweise wird sichergestellt, dass verschiedene Perspektiven berücksichtigt werden – ein entscheidender Schritt, um die Digitalisierung im Gesundheitswesen erfolgreich und nachhaltig voranzutreiben.
3. Künstliche Intelligenz für Entscheidungsunterstützung implementieren
Die Integration von Künstlicher Intelligenz (KI) im Gesundheitswesen eröffnet spannende Möglichkeiten, um datengestützte Entscheidungen auf Führungsebene zu treffen. Aufbauend auf bestehenden Strukturen kann KI nicht nur die abteilungsübergreifende Zusammenarbeit unterstützen, sondern auch Routineaufgaben automatisieren und Arbeitsabläufe digitalisieren. Das Ergebnis? Führungskräfte gewinnen mehr Zeit für strategische Themen, während datenbasierte Ansätze die Qualität ihrer Entscheidungen verbessern. Die Haufe Akademie beschreibt diesen Wandel treffend:
"KI im Unternehmen wird dabei auch die Führungsarbeit grundlegend verändern – sie unterstützt Sie bei datenbasierten Entscheidungen und übernimmt Routineaufgaben, während Sie sich auf strategische Themen konzentrieren." [5]
"Sie erreichen eine höhere Produktivität durch digitalisierte Workflows und steigern die Entscheidungsqualität durch datenbasierte Ansätze." [5]
Damit die Einführung von KI gelingt, ist es entscheidend, geeignete Anwendungsbereiche zu identifizieren und die Lösungen nahtlos in die vorhandenen IT-Strukturen zu integrieren. Dabei müssen selbstverständlich alle Datenschutzvorgaben eingehalten werden. Um die Akzeptanz der neuen Technologien zu fördern, sind maßgeschneiderte Schulungen und eine offene, transparente Kommunikation essenziell. Experten wie Dr. Sven Jungmann bieten hierzu Keynotes und Beratungen an, die Organisationen dabei helfen, den Übergang zu datenbasierter Führung erfolgreich zu gestalten.
Ein weiterer wichtiger Punkt: Die Systeme sollten regelmäßig überwacht und angepasst werden, um sicherzustellen, dass sie stets aktuelle und qualitativ hochwertige Ergebnisse liefern.
4. Eine Führungskultur schaffen, die alle Stimmen wertschätzt
Nachhaltige Veränderungen gelingen nur, wenn alle Beteiligten aktiv einbezogen werden. Eine Führungskultur, die Vielfalt respektiert und unterschiedliche Perspektiven berücksichtigt, ist der Schlüssel dazu. Während KI-Systeme datenbasierte Entscheidungsgrundlagen bieten, sind es letztlich die Menschen mit ihren individuellen Erfahrungen und Sichtweisen, die den Wandel vorantreiben. Diese Zusammenarbeit bildet die Grundlage für ein vertrauensvolles Arbeitsumfeld.
Ein entscheidender Faktor dabei ist psychologische Sicherheit. Mitarbeitende sollten sich frei fühlen, ihre Meinungen, Bedenken und Ideen zu äußern. Gerade im Gesundheitswesen, wo verschiedene Berufsgruppen wie Pflegekräfte, Ärztinnen und Ärzte sowie IT-Fachleute zusammenarbeiten, ist es wichtig, dass jede Expertise gehört wird.
Regelmäßiges Feedback ist ebenfalls unverzichtbar. Führungskräfte sollten sowohl auf formelle Wege wie Mitarbeiterbefragungen als auch auf informelle Gespräche setzen, um ihre Strategien anzupassen. Besonders wertvoll sind die Einsichten derjenigen, die täglich mit digitalen Systemen arbeiten – ihre praktischen Erfahrungen liefern oft entscheidende Impulse.
Ein weiterer zentraler Punkt ist die Förderung unterschiedlicher Denkansätze. Interdisziplinäre Teams, die verschiedene Hintergründe und Erfahrungen vereinen, entwickeln oft die besten Lösungen. Diese Vielfalt schafft eine offenere Entscheidungsfindung, bei der alle Stimmen gehört werden.
Darüber hinaus ist es wichtig, dass Führungskräfte aktiv zuhören und Entscheidungen transparent kommunizieren. Wenn Mitarbeitende sehen, wie ihre Beiträge in strategische Entscheidungen einfließen, steigt ihre Motivation und Bereitschaft, Veränderungen mitzutragen. Eine solche Kultur des Vertrauens ist unverzichtbar, um digitale Innovationen erfolgreich umzusetzen.
sbb-itb-49a712f
5. Klare Kommunikation während der digitalen Transformation aufrechterhalten
Eine der häufigsten Stolperfallen bei digitalen Transformationen ist mangelhafte Kommunikation. Wenn Mitarbeitende nicht verstehen, warum neue Systeme eingeführt werden oder wie diese ihren Arbeitsalltag beeinflussen, kann das schnell zu Unsicherheiten und Widerstand führen. Deshalb ist eine offene, klare und kontinuierliche Kommunikation entscheidend, um alle Beteiligten mitzunehmen.
Setzen Sie klare Erwartungen von Anfang an. Es ist wichtig, frühzeitig und offen über bevorstehende Veränderungen zu sprechen. Teilen Sie mit, welche Herausforderungen auftreten könnten, welche Vorteile langfristig zu erwarten sind und wie die einzelnen Schritte zeitlich geplant sind. Dabei sollten Sie realistische Zeitrahmen setzen und auch mögliche Stolpersteine nicht verschweigen.
Wählen Sie passende Kommunikationskanäle. Technische Details lassen sich oft besser schriftlich erklären, während sensible Themen in persönlichen Gesprächen besser aufgehoben sind. Regelmäßige Updates zum Fortschritt der Digitalisierungsprojekte sorgen dafür, dass alle auf dem gleichen Stand bleiben.
Passen Sie Ihre Botschaften an die Zielgruppe an. Unterschiedliche Berufsgruppen haben unterschiedliche Informationsbedürfnisse. Pflegekräfte brauchen andere Details als IT-Expert:innen oder Verwaltungsmitarbeitende. Vermeiden Sie unnötigen Fachjargon und setzen Sie auf eine verständliche Sprache. Konkrete Beispiele aus dem Arbeitsalltag machen abstrakte Konzepte greifbarer und helfen, die Vorteile neuer Systeme zu verdeutlichen.
Fördern Sie den Dialog. Kommunikation ist keine Einbahnstraße. Führungskräfte sollten aktiv nach Feedback fragen und Raum für offene Diskussionen schaffen. Wenn Mitarbeitende merken, dass ihre Rückmeldungen ernst genommen werden, steigt die Bereitschaft, sich auf Veränderungen einzulassen.
Sobald ein offener Austausch etabliert ist, stärken Sie das Vertrauen, indem Sie regelmäßig Rückmeldungen geben. Gerade in kritischen Phasen der Transformation ist es wichtig, kleine Erfolge zu teilen und Fortschritte zu feiern. Das motiviert und zeigt, dass der Prozess in die richtige Richtung geht. Gleichzeitig sollten Probleme nicht unter den Teppich gekehrt, sondern offen angesprochen und gemeinsam gelöst werden. So schaffen Sie eine Atmosphäre, in der Veränderungen als Chance wahrgenommen werden.
6. Finanzielle Nachhaltigkeit durch kluge Investitionen sicherstellen
Digitale Gesundheitstechnologien bringen oft hohe Anfangsinvestitionen mit sich, deren Nutzen sich erst über einen längeren Zeitraum entfaltet. Führungskräfte im Gesundheitswesen stehen dabei vor der Aufgabe, den Return on Investment (ROI) realistisch einzuschätzen und gleichzeitig Patientenergebnisse sowie Kosteneffizienz in Einklang zu bringen.
Denken Sie langfristig: Traditionelle Planungsmodelle mit einem Zeithorizont von fünf Jahren übersehen häufig die langfristigen Qualitätsverbesserungen. Digitale Gesundheitslösungen zeigen ihren vollen Nutzen oft erst nach drei Jahren. Es empfiehlt sich daher, mittel- bis langfristig zu planen – also über 7 bis 10 Jahre oder länger [7]. Eine strukturierte Kalkulation auf dieser Basis schafft Klarheit.
Nutzen Sie umfassende Kosten-Nutzen-Analysen: Das eHealth-CBA-Framework bietet eine fundierte Grundlage, um finanzielle und wirtschaftliche Werte aus verschiedenen Perspektiven zu bewerten – von der internen Effizienz bis hin zur Verteilung zwischen Stakeholdern. Dieses Modell orientiert sich an den vier Kernzielen des Gesundheitswesens: der Verbesserung der Bevölkerungsgesundheit, der Steigerung der Patientenerfahrung, der Senkung der Kosten pro Patient und der besseren Work-Life-Balance der Mitarbeitenden [7].
Direkte und indirekte Effekte messen: Die Einführung elektronischer Patientenakten (EMR) bietet zahlreiche Vorteile. Dazu gehören eine verbesserte Patientenerfahrung, weniger unerwünschte Ereignisse, kürzere Krankenhausaufenthalte, Zeitersparnis durch virtuelle Versorgung, höhere Produktivität der Mitarbeitenden und Einsparungen bei den medizinischen Kosten pro Patient [7].
Digitalisierungsprojekte strategisch angehen: Neue Technologien sollten immer in bestehende Strategien eingebettet werden, um Ressourcenverschwendung zu vermeiden. Wertorientierte Geschäftsmodelle, die ethische und gesellschaftliche Vorteile mit finanzieller Tragfähigkeit verbinden, sind hier entscheidend [6] [8].
Nicht-monetäre Kosten berücksichtigen: Dazu zählen Infrastrukturinvestitionen, laufende Kosten für den Betrieb und die Wartung von EMR-Systemen sowie zusätzliche Ausgaben, die durch eine erhöhte Patientennachfrage entstehen können. Eine transparente Aufschlüsselung dieser Kosten hilft, realistische Budgets zu erstellen und unerwartete Ausgaben zu vermeiden. Diese präzise Planung bildet die Grundlage für weitere digitale Initiativen.
7. Eine flexible Infrastruktur für digitale Innovationen schaffen
Um die digitale Transformation im Gesundheitswesen erfolgreich voranzutreiben, braucht es eine technische Basis, die nicht nur den aktuellen Anforderungen gerecht wird, sondern auch Raum für zukünftige Technologien bietet. Führungskräfte stehen vor der Aufgabe, eine IT-Infrastruktur zu entwickeln, die sowohl flexibel als auch skalierbar ist. Diese Grundlage ermöglicht es, Innovationen nachhaltig umzusetzen und den steigenden Anforderungen gerecht zu werden.
Eine skalierbare Architektur aufbauen: Der Schlüssel zu erfolgreichen digitalen Gesundheitsinitiativen liegt in einer Infrastruktur, die mit den Anforderungen wächst, ohne dabei an Leistung einzubüßen oder die Kosten in die Höhe zu treiben. Besonders im Gesundheitswesen, wo digitale Versorgungsnetze immer wichtiger werden, ist eine solche Architektur unverzichtbar. Sie gewährleistet nicht nur effiziente Prozesse, sondern auch einen reibungslosen Datenaustausch, der für langfristige Fortschritte entscheidend ist [9].
Interoperabilität als Grundstein setzen: Gesundheitssysteme der Zukunft müssen miteinander vernetzt sein, um einen nahtlosen Informationsfluss zu ermöglichen. Nur so können patientenzentrierte Dienstleistungen gewährleistet werden. Interoperabilität ist dabei kein optionales Merkmal, sondern eine Grundvoraussetzung [4].
Sichere Plattformen für Datenaustausch etablieren: Sicherheit spielt eine zentrale Rolle im Gesundheitswesen. Der kontrollierte Austausch sensibler Daten erfordert Plattformen, die höchsten Sicherheitsstandards entsprechen. Diese Lösungen sorgen dafür, dass Informationen sicher zwischen den verschiedenen Akteuren im Gesundheitssektor fließen können, ohne dabei die Integrität der Daten zu gefährden.
Fazit
Erfolgreiche digitale Führungsstrategien stützen sich auf die zuvor beschriebenen Ansätze. Die digitale Transformation im Gesundheitswesen verlangt durchdachte und langfristige Strategien. Die sieben vorgestellten Methoden bilden ein zusammenhängendes Konzept, das Führungskräften hilft, ihre Organisation sicher durch den digitalen Wandel zu steuern.
Dabei steht die kontinuierliche Weiterentwicklung und das Wohlbefinden der Mitarbeitenden im Mittelpunkt. Abteilungsübergreifende Zusammenarbeit erhöht nicht nur die Effizienz, sondern legt auch die Basis für nachhaltige Veränderungen.
Führungskräfte, die künstliche Intelligenz gezielt und strategisch nutzen, können sich entscheidende Vorteile verschaffen – sowohl im Wettbewerb als auch in der Verbesserung der Patientenversorgung.
Eine Führungskultur, in der alle Stimmen gehört werden, fördert Innovation und stärkt das Vertrauen der Mitarbeitenden in den Veränderungsprozess. Klare und offene Kommunikation während der Transformation verhindert Missverständnisse und fördert die notwendige Akzeptanz auf allen Ebenen.
Gezielte Investitionen in strategische Bereiche sind der Schlüssel zum langfristigen Erfolg digitaler Initiativen. Organisationen, die ihre Ressourcen klug einsetzen, können sowohl aktuelle Herausforderungen bewältigen als auch langfristige Ziele erreichen.
Eine skalierbare und interoperable IT-Infrastruktur bildet das Fundament für digitale Projekte. Ohne sie bleiben Initiativen oft unzusammenhängend und ineffektiv.
Mit einer starken technischen Basis können KI-gestützte Entscheidungen getroffen werden, während eine offene Kommunikationskultur die Zusammenarbeit zwischen Abteilungen stärkt. Klug geplante Investitionen sorgen dafür, dass sowohl die technische Infrastruktur als auch die Weiterentwicklung der Mitarbeitenden kontinuierlich vorangetrieben werden. Die Zukunft der digitalen Gesundheit entsteht durch die Verbindung von mitarbeiterorientierter Führung, technischer Kompetenz und klarer Kommunikation.
Dr. Sven Jungmann bietet praxisnahe Keynotes und Vorträge, die den Transformationsprozess im Gesundheitswesen greifbar machen. Seine maßgeschneiderten Inhalte zu künstlicher Intelligenz, Innovation und digitaler Gesundheit liefern wertvolle Einblicke in technologische Entwicklungen und unterstützen dabei, die digitale Transformation effektiv zu gestalten und umzusetzen.
FAQs
Wie können Führungskräfte im Gesundheitswesen ihre Teams dabei unterstützen, digitale Kompetenzen zu entwickeln?
Führungskräfte im Gesundheitswesen spielen eine entscheidende Rolle dabei, ihre Teams fit für die digitale Zukunft zu machen. Eine klare digitale Vision ist dabei der erste Schritt. Indem sie regelmäßig Weiterbildungsangebote wie Workshops oder Schulungen bereitstellen und den Zugang zu modernen digitalen Tools ermöglichen, schaffen sie die Grundlage für den Kompetenzaufbau.
Ebenso wichtig ist es, ein Arbeitsumfeld zu fördern, das Innovation und Offenheit gegenüber neuen Technologien unterstützt. Mitarbeitende sollten dazu ermutigt werden, digitale Lösungen eigenständig zu erkunden und anzuwenden. So können sie aktiv an der digitalen Transformation mitwirken und neue Ansätze in den Arbeitsalltag integrieren.
Regelmäßige Kommunikation und konstruktives Feedback sind dabei unerlässlich. Sie helfen den Teams, sich sicher im Umgang mit digitalen Technologien zu fühlen und deren Möglichkeiten optimal zu nutzen. So wird die digitale Kompetenz nicht nur aufgebaut, sondern auch nachhaltig gestärkt.
Wie verändert Künstliche Intelligenz die Entscheidungsfindung in der digitalen Gesundheit, und wie lässt sie sich erfolgreich einsetzen?
Künstliche Intelligenz (KI) verändert die Art und Weise, wie Entscheidungen im Gesundheitswesen getroffen werden. Durch die Analyse riesiger Datenmengen ermöglicht sie präzise, individuell angepasste Empfehlungen. Ob es darum geht, Muster zu erkennen, Diagnosen zu unterstützen oder personalisierte Behandlungspläne zu erstellen – KI trägt dazu bei, die Effizienz zu steigern und gleichzeitig die Qualität der Patientenversorgung zu verbessern.
Damit KI jedoch ihr volles Potenzial entfalten kann, ist eine gezielte Anwendung in Schlüsselbereichen notwendig. Dazu gehören:
- Analyse medizinischer Bilddaten: KI kann dabei helfen, Anomalien in Röntgenbildern oder MRT-Scans schneller und genauer zu identifizieren.
- Unterstützung bei chirurgischen Eingriffen: Präzisionswerkzeuge, die durch KI gesteuert werden, können Chirurgen bei komplexen Operationen unterstützen.
- Optimierung der Telemedizin: KI-basierte Systeme können die Kommunikation zwischen Ärzten und Patienten effizienter gestalten und Diagnosen in Echtzeit unterstützen.
Ein entscheidender Faktor für den Erfolg ist die Benutzerfreundlichkeit dieser Technologien. KI-Lösungen müssen so gestaltet sein, dass sie nahtlos in bestehende Arbeitsabläufe integriert werden können. Nur so gewinnen sie das Vertrauen und die Akzeptanz von medizinischem Fachpersonal und Patienten gleichermaßen.
Warum ist eine klare Kommunikation während der digitalen Transformation im Gesundheitswesen entscheidend und wie lässt sie sich effektiv gestalten?
Eine klare und zielgerichtete Kommunikation spielt eine Schlüsselrolle, um alle Beteiligten während der digitalen Transformation mitzunehmen und Akzeptanz für Veränderungen zu schaffen. Ohne eine verständliche und offene Kommunikation können Missverständnisse entstehen, die den Fortschritt behindern.
Um dies zu vermeiden, ist es entscheidend, klare Verantwortlichkeiten festzulegen und konkrete, messbare Ziele zu definieren. Ebenso wichtig ist es, sowohl Fachkräfte als auch Patientinnen und Patienten aktiv in den Prozess einzubeziehen. Durch regelmäßiges Feedback und transparente Informationen kann Vertrauen aufgebaut werden, was wiederum die Akzeptanz und den Erfolg der Veränderungen stärkt.
Verwandte Blogbeiträge
- Digitale Transformation erfolgreich umsetzen
- Wie KI Gesundheitsorganisationen transformiert
- Studie: Zukunftstrends bei digitalen Kompetenzen im Gesundheitswesen
- 5 Wege, wie KI Ärzte zu Führungskräften macht
NLP in der Medizin: Biomarker-Entdeckung optimieren
Die Entdeckung von Biomarkern wird durch den Einsatz von NLP (Natural Language Processing) revolutioniert. Diese Technologie analysiert biomedizinische Texte schneller und präziser als manuelle Methoden, indem sie Muster in großen Datenmengen erkennt. Modelle wie BERT und BioBERT sowie Deep-Learning-Ansätze bieten neue Möglichkeiten, während manuelle Recherchen weiterhin eine wichtige Rolle spielen. Jede Methode hat Vor- und Nachteile:
- NLP-Modelle (z. B. BioBERT): Schnell, präzise, skalierbar, aber erfordert technisches Know-how.
- Manuelle Recherche: Kontextbewertung durch Experten, aber zeitintensiv und ineffizient bei großen Datenmengen.
- Deep Learning: Erkennt komplexe Muster, benötigt jedoch hohe Rechenleistung und spezialisierte Fachkenntnisse.
Fazit: Eine Kombination aus NLP, manuellen Methoden und Deep Learning kann die Effizienz und Genauigkeit in der Biomarker-Forschung steigern.
1. NLP-basierte Modelle (BERT, BioBERT)
Die Entwicklungen im Bereich Natural Language Processing (NLP) haben die biomedizinische Forschung revolutioniert. Modelle wie BERT und dessen spezialisierte Variante BioBERT setzen auf fortschrittliche Lernmethoden, um wissenschaftliche Texte effizient zu analysieren und potenzielle Biomarker zu identifizieren.
Hier ein Blick auf die wichtigsten Vorteile dieser Modelle: Effizienz, Präzision, Skalierbarkeit und ihre Einbindung in Forschungsprozesse.
Effizienz
NLP-Modelle können riesige Mengen an Textdaten in kürzester Zeit analysieren. Sie durchforsten Datenbanken, erkennen Muster und decken Zusammenhänge auf, die bei manuellen Analysen oft unentdeckt bleiben.
Präzision
BioBERT ist darauf ausgelegt, sowohl direkt als auch indirekt beschriebene Biomarker zu erkennen. Besonders bei der Named Entity Recognition trennt es zuverlässig zwischen protein-, genetischen und metabolischen Markern, was die Qualität der Ergebnisse erheblich verbessert.
Skalierbarkeit
Ein weiterer Vorteil dieser Modelle ist ihre Skalierbarkeit. Sie können problemlos parallel auf mehreren Systemen betrieben werden und lassen sich schnell an neue Forschungsbereiche anpassen – ein deutlicher Vorteil gegenüber zeitaufwendigen manuellen Methoden.
Integration in Forschungsprozesse
Dank standardisierter Schnittstellen lassen sich NLP-Systeme einfach in bestehende Forschungsinfrastrukturen einbinden. Sie exportieren strukturierte Ergebnisse direkt in Datenbanken und ermöglichen es Forschungsteams, mithilfe automatisierter Analysen stets auf dem neuesten Stand zu bleiben.
Mit diesen Stärken sind NLP-basierte Modelle ein unverzichtbares Werkzeug für die moderne Biomarker-Forschung.
2. Manuelle Literaturrecherche-Methoden
Die manuelle Literaturrecherche umfasst das systematische Durchsuchen von Fachdatenbanken wie PubMed, Embase oder der Cochrane Library, um relevante Studien zu Biomarkern zu identifizieren.
Effizienz
Manuelle Recherche ist ein zeitaufwendiger Prozess. Allein die Entwicklung passender Suchstrategien, inklusive der Nutzung von Boolean-Operatoren, kann Wochen in Anspruch nehmen. Besonders bei umfangreichen systematischen Reviews steigt der Aufwand erheblich, da jede Studie sorgfältig geprüft und bewertet werden muss.
Genauigkeit
Ein großer Vorteil der manuellen Recherche liegt in der Fähigkeit, wissenschaftliche Texte im Kontext zu bewerten. Erfahrene Wissenschaftler können feine Details erkennen, die Qualität der Studien beurteilen und methodische Schwächen identifizieren. Diese Expertise ist entscheidend, um die klinische Bedeutung von Biomarker-Studien präzise einzuschätzen.
Skalierbarkeit
Die manuelle Recherche stößt jedoch schnell an ihre Grenzen. Mit der stetig wachsenden Anzahl wissenschaftlicher Publikationen wird es nahezu unmöglich, alle relevanten Studien vollständig zu erfassen. Forschungsteams müssen zwangsläufig Prioritäten setzen und sich auf spezifische Themenbereiche konzentrieren.
Integration in Forschungsabläufe
Die Einbindung manueller Methoden in moderne Forschungsprozesse erfordert zusätzliche Arbeitsschritte. Forscher nutzen Referenzmanagement-Tools wie EndNote oder Zotero, um ihre Literatursammlungen zu organisieren. Dennoch bleibt die Übertragung der Erkenntnisse in strukturierte Datenbanken zeitintensiv und erfordert eine enge Abstimmung innerhalb der Teams.
Manuelle Recherchen bieten zwar eine tiefgehende kontextuelle Analyse, doch die zunehmenden Herausforderungen in diesem Bereich haben den Einsatz moderner Technologien wie NLP-Modellen (Natural Language Processing) vorangetrieben. Diese können den Prozess effizienter gestalten und die Entdeckung neuer Biomarker unterstützen, wodurch beide Ansätze eine wertvolle Ergänzung zueinander darstellen.
3. Deep-Learning-Techniken
Zusätzlich zu den NLP-Methoden bieten Deep-Learning-Techniken eine weitere Dimension bei der Entdeckung von Biomarkern. Mithilfe neuronaler Netzwerke können diese Ansätze komplexe Muster erkennen und sowohl strukturierte als auch unstrukturierte Daten gleichzeitig analysieren – ein klarer Vorteil gegenüber traditionellen NLP-Modellen.
Effizienz
Deep-Learning-Modelle zeigen ihre Stärke besonders in der parallelen Verarbeitung großer Datenmengen. Convolutional Neural Networks (CNNs) können in multimodalen Ansätzen riesige Mengen an Forschungsartikeln analysieren und dabei Text, Tabellen und Bildmaterial einbeziehen. Zwar erfordert das Training dieser Modelle erhebliche Rechenressourcen, doch die anschließenden Analysen lassen sich in Sekundenschnelle durchführen.
Recurrent Neural Networks (RNNs) und Long Short-Term Memory (LSTM)-Netzwerke sind darauf spezialisiert, zeitliche Sequenzen zu analysieren. Sie können Biomarker-Verläufe über verschiedene Studienphasen hinweg präzise verfolgen und Zusammenhänge aufdecken, die bei statischen Analysen oft verborgen bleiben. Diese Geschwindigkeit und Präzision machen sie zu einem unverzichtbaren Werkzeug in der Biomarker-Forschung.
Genauigkeit
Die Leistungsfähigkeit von Deep-Learning-Systemen hängt stark von der Qualität und Menge der Trainingsdaten ab. Transformer-Modelle beispielsweise können komplexe semantische Beziehungen zwischen verschiedenen Biomarkern erfassen und gleichzeitig Muster in hochdimensionalen Daten erkennen. Dadurch werden auch indirekte Zusammenhänge sichtbar, die herkömmliche Methoden möglicherweise übersehen.
Graph Neural Networks (GNNs) gehen noch einen Schritt weiter, indem sie Protein-Protein-Interaktionen modellieren. Dadurch können potenzielle neue Biomarker identifiziert werden, die in anderen Analysen unentdeckt bleiben.
Skalierbarkeit
Ein großer Vorteil von Deep Learning ist die Möglichkeit, heterogene Datentypen auf Millionen von Dokumenten gleichzeitig zu verarbeiten. Multi-Modal Learning kombiniert dabei Textdaten, Genomsequenzen, Proteinstrukturen und klinische Bilder, um eine umfassendere Analyse zu ermöglichen. Cloud-basierte Plattformen tragen dazu bei, diese Ansätze flexibel und kosteneffizient zu skalieren, ohne dass teure Hardware angeschafft werden muss.
Integration in den Forschungsprozess
Die erfolgreiche Einbindung von Deep-Learning-Systemen in die Forschung erfordert eine gut durchdachte Infrastruktur und spezialisierte Fachkenntnisse. Automatisierte Workflows, die von der Datenaufbereitung bis zur Modellbereitstellung reichen, können kontinuierlich neue Publikationen überwachen und auf potenzielle Biomarker hinweisen.
Ein entscheidender Vorteil liegt in der Möglichkeit zur kontinuierlichen Optimierung durch Transfer Learning. Bereits trainierte Modelle können mit neuen Datensätzen verfeinert werden, ohne dass ein vollständiges Retraining notwendig ist. Dadurch können Forschungsteams sowohl von bestehenden Erkenntnissen profitieren als auch ihre Modelle schneller weiterentwickeln.
Die Einführung solcher Systeme erfordert jedoch eine enge Zusammenarbeit zwischen Bioinformatikern, Medizinern und Data Scientists. Nur so kann sichergestellt werden, dass die technischen Möglichkeiten optimal auf die jeweiligen Forschungsfragen abgestimmt sind.
sbb-itb-49a712f
Vor- und Nachteile
Hier sind die wichtigsten Vor- und Nachteile der beschriebenen Methoden zusammengefasst. Die folgende Tabelle bietet einen schnellen Überblick, wie sich die Ansätze bewerten lassen:
| Ansatz | Effizienz | Genauigkeit | Skalierbarkeit | Integration |
|---|---|---|---|---|
| NLP-Modelle (BERT, BioBERT) | Sehr hoch | Hoch | Sehr hoch | Mittel |
| Manuelle Literaturrecherche | Niedrig | Mittel bis hoch | Sehr niedrig | Hoch |
| Deep-Learning-Techniken | Hoch | Sehr hoch | Hoch | Eingeschränkt |
Stärken der NLP-basierten Modelle
NLP-Modelle bieten eine automatisierte und systematische Möglichkeit, große Mengen an Textdaten zu analysieren. Ihre Geschwindigkeit und Objektivität machen sie besonders nützlich in der Biomarker-Forschung, wo es auf präzise und reproduzierbare Ergebnisse ankommt.
Herausforderungen bei der Integration von NLP
Die Integration solcher Modelle ist jedoch nicht ohne Hürden. Sie erfordert spezielles Fachwissen und Anpassungen an den jeweiligen Forschungsbereich. Außerdem können NLP-Modelle oft sprachliche Feinheiten oder komplexe Kontexte nicht vollständig erfassen, was bei der Interpretation wissenschaftlicher Studien problematisch sein kann.
Vorteile der manuellen Literaturrecherche
Die manuelle Recherche punktet mit ihrer Fähigkeit, Studien im Kontext zu bewerten. Erfahrene Forscher können die Qualität und Relevanz von Arbeiten besser einschätzen – und das ohne den Einsatz komplexer Technologien. Zudem lässt sich diese Methode leicht in bestehende Arbeitsabläufe integrieren.
Limitationen manueller Methoden
Allerdings ist die manuelle Recherche äußerst zeitaufwendig und ineffizient, besonders angesichts der stetig wachsenden Menge an medizinischen Publikationen. Die begrenzte Arbeitskapazität einzelner Forscher und die Gefahr von Ermüdung können zu ungenauen oder inkonsistenten Ergebnissen führen.
Potenzial und Komplexität von Deep-Learning-Techniken
Deep-Learning-Techniken sind in der Lage, komplexe Muster in großen Datensätzen zu erkennen und tiefere Einblicke zu liefern. Dennoch sind sie ressourcenintensiv und erfordern ein hohes Maß an technischem Know-how, was ihren Einsatz für kleinere Forschungsteams erschwert.
Praktische Überlegungen zur Methodenwahl
Die Wahl der geeigneten Methode hängt stark von den verfügbaren Ressourcen und den Forschungszielen ab. NLP-Modelle eignen sich hervorragend für eine schnelle Vorauswahl, während die manuelle Recherche eine kontextbezogene Bewertung sicherstellt. Deep-Learning-Techniken sind ideal, um tiefere Zusammenhänge in den Daten zu erkennen. Eine Kombination dieser Ansätze könnte die Stärken jeder Methode optimal nutzen.
Fazit
Die Untersuchung zeigt deutlich, wie NLP-Modelle wie BERT und BioBERT die Art und Weise verändern, wie Biomarker entdeckt werden. Ihre Fähigkeit, riesige Mengen wissenschaftlicher Literatur systematisch und schnell zu analysieren, übertrifft traditionelle manuelle Methoden deutlich in Bezug auf Tempo und Skalierbarkeit. Doch beide Ansätze – manuell und KI-gestützt – haben ihre eigenen Stärken und Herausforderungen.
Die manuelle Literaturrecherche bleibt essenziell, da sie auf menschlicher Expertise basiert, um komplexe Zusammenhänge zu bewerten und die Relevanz von Studien präzise einzuschätzen. Auf der anderen Seite bieten Deep-Learning-Techniken die Möglichkeit, tiefere Muster in großen Datenmengen zu erkennen, verlangen jedoch umfangreiche technische Ressourcen und sorgfältige Anpassungen.
Für eine erfolgreiche Integration solcher Technologien in deutsche Gesundheitseinrichtungen ist es entscheidend, sie an spezifische Anforderungen und regulatorische Vorgaben anzupassen. Dabei wird klar, dass ein hybrider Ansatz, der die jeweiligen Vorteile kombiniert, das größte Potenzial bietet.
Ein solcher Ansatz vereint die Geschwindigkeit und Skalierbarkeit von NLP-Modellen, die kontextuelle Präzision manueller Analysen und die tiefgehenden Einsichten, die durch Deep Learning möglich werden. NLP-Modelle können die erste Analyse von Literatur erheblich beschleunigen, während die manuelle Überprüfung sicherstellt, dass die Ergebnisse qualitativ hochwertig bleiben. Deep-Learning-Techniken können schließlich zusätzliche, tiefere Erkenntnisse liefern.
Organisationen, die diese Technologien einführen möchten, können von spezialisierten Experten wie Dr. Sven Jungmann profitieren. Seine Erfahrung in der Anwendung von KI im Gesundheitswesen bietet wertvolle Unterstützung bei der Integration solcher Systeme in bestehende Arbeitsprozesse und bei der Entwicklung praktikabler Strategien.
Die Zukunft der Biomarker-Entdeckung liegt in der intelligenten Verbindung menschlicher Expertise mit modernen KI-Technologien. Dieser Ansatz hat das Potenzial, die Effizienz und Genauigkeit in der medizinischen Forschung nachhaltig zu steigern.
FAQs
Wie trägt NLP dazu bei, die Entdeckung von Biomarkern effizienter und präziser zu machen?
Natural Language Processing (NLP) hat die Art und Weise, wie Biomarker entdeckt werden, grundlegend verändert. Es ermöglicht die Analyse riesiger Mengen unstrukturierter Daten, wie beispielsweise elektronischer Gesundheitsakten (EHRs). Dadurch können Krankheitsmuster und Risikogruppen nicht nur schneller, sondern auch präziser erkannt werden als mit herkömmlichen Methoden.
Ein spannender Aspekt dabei sind die sogenannten digitalen Biomarker. Sie helfen, Hochrisikogruppen gezielt zu identifizieren und maßgeschneiderte Behandlungsstrategien zu entwickeln. Das Ergebnis? Eine beschleunigte Forschung und eine deutlich verbesserte Patientenversorgung.
Welche Herausforderungen bringt der Einsatz von Deep Learning in der Biomarker-Forschung mit sich?
Der Einsatz von Deep-Learning-Techniken in der Biomarker-Forschung bringt einige wichtige Herausforderungen mit sich. Eine der größten Hürden ist der Bedarf an umfangreichen, hochwertig annotierten Datensätzen, die für das Training solcher Modelle unerlässlich sind. In Europa wird dies zusätzlich durch die strengen Datenschutzvorschriften erschwert. Die Anonymisierung medizinischer Daten ist besonders kompliziert, da es keine einheitliche Regelung gibt, welche Informationen entfernt werden müssen, um einen vollständigen Schutz zu gewährleisten.
Darüber hinaus erfordert die Entwicklung und der Einsatz solcher Technologien nicht nur erhebliche finanzielle und personelle Ressourcen, sondern auch ein hohes Maß an Fachwissen. Forscher und Entwickler stehen vor der Aufgabe, Wege zu finden, Daten optimal zu nutzen und gleichzeitig die gesetzlichen Anforderungen einzuhalten. Trotz dieser Herausforderungen bietet Deep Learning beeindruckende Möglichkeiten, die Präzision und Effizienz in der biomarkerbasierten Forschung deutlich zu verbessern.
Welche Bedeutung hat die manuelle Literaturrecherche noch in der Biomarker-Forschung, obwohl NLP- und Deep-Learning-Methoden immer leistungsfähiger werden?
Die manuelle Literaturrecherche bleibt trotz beeindruckender Fortschritte in NLP- und Deep-Learning-Technologien ein unverzichtbarer Bestandteil der Biomarker-Forschung. Warum? Weil sie sicherstellt, dass Studien sorgfältig geprüft werden und keine wichtigen Details verloren gehen – besonders in Fällen, in denen NLP-Tools an ihre Grenzen stoßen oder spezifische wissenschaftliche Feinheiten nicht vollständig erfassen können.
Ein weiterer Vorteil: Die manuelle Recherche ermöglicht es, kritisches Denken und persönliche Expertise einzubringen. Das ist besonders wertvoll, wenn es um die Interpretation komplexer oder mehrdeutiger Daten geht. Automatisierte und manuelle Ansätze ergänzen sich hier perfekt, um die Qualität und Aussagekraft der Forschungsergebnisse zu steigern.
Verwandte Blogbeiträge
- KI im Gesundheitswesen: 7 praktische Anwendungen
- Wie NLP die ICD-10-Kodierung verbessert
- KI-gestützte Innovation: Beispiele aus dem Gesundheitswesen
- Seltene Krankheiten: Wie maschinelles Lernen hilft
Regulierungsrahmen für KI in der Radiologie
Künstliche Intelligenz (KI) verändert die Radiologie grundlegend, doch klare Regeln sind entscheidend, um Sicherheit und Vertrauen zu gewährleisten.
Die Analyse medizinischer Bilddaten durch KI spart Zeit, erhöht die Präzision und entlastet Fachkräfte. Gleichzeitig birgt der Einsatz Risiken, wie fehlerhafte Diagnosen oder Datenschutzprobleme. Deutschland und die EU setzen auf strenge Vorgaben wie den EU AI Act und die Medizinprodukteverordnung (MDR), um Patientensicherheit sicherzustellen. Im Vergleich dazu verfolgt die USA flexiblere Ansätze, die Innovationen schneller ermöglichen, jedoch weniger strikte Kontrollen erfordern.
Kernpunkte:
- EU-Ansatz: Strenge Anforderungen an Transparenz, Genauigkeit und Überwachung.
- USA-Ansatz: Schnellere Zulassung durch risikobasierte Verfahren.
- Herausforderungen: Datenschutz, klinische Integration und hohe regulatorische Hürden in Deutschland.
- Zukunft: Anpassung der Regeln für selbstlernende Systeme und Nutzung von klinischen Alltagsdaten.
Die Balance zwischen Sicherheit und Fortschritt bleibt der Schlüssel für eine erfolgreiche Integration von KI in der Radiologie.
Internationale Regulierungsansätze für KI in der Radiologie
Europäische Union: EU AI Act und MDR
Die Europäische Union hat mit dem EU AI Act einen Rahmen geschaffen, der KI-Anwendungen in der Medizin als Hochrisikosysteme einstuft. Das bedeutet, dass solche Systeme strenge Anforderungen erfüllen müssen, um zugelassen zu werden.
In der Radiologie gelten KI-Systeme als besonders kritisch, da sie direkte Auswirkungen auf die Patientensicherheit haben können. Hersteller müssen umfassende Konformitätsbewertungsverfahren durchlaufen, bevor ihre Produkte auf den Markt kommen. Eine zentrale Vorgabe ist dabei die menschliche Aufsicht: KI-Systeme sollen so gestaltet sein, dass medizinische Fachkräfte sie überwachen und bei Bedarf eingreifen können. Die endgültige Entscheidung bleibt stets bei einem Radiologen.
Zusätzlich regelt die Medizinprodukteverordnung (MDR), die seit Mai 2021 in Kraft ist, die Zulassung von KI-basierten Medizinprodukten. Hierbei verlangt die MDR klinische Bewertungen und eine kontinuierliche Überwachung nach der Markteinführung. Hersteller müssen belegen, dass ihre Systeme nicht nur technisch zuverlässig sind, sondern auch einen echten klinischen Nutzen bieten und sicher eingesetzt werden können.
Vereinigte Staaten: FDA-Regulierungen
Die Food and Drug Administration (FDA) in den USA verfolgt einen flexibleren Ansatz. Bereits viele KI-basierte Medizinprodukte, insbesondere in der Radiologie, haben dort eine Zulassung erhalten. Dies zeigt die Offenheit der FDA gegenüber neuen Technologien.
Im Fokus steht die Klassifizierung als Software as Medical Device (SaMD). Die FDA teilt diese Software in verschiedene Risikoklassen ein und passt die Zulassungsanforderungen entsprechend an. Viele radiologische KI-Anwendungen nutzen das 510(k)-Verfahren, das eine schnellere Markteinführung ermöglicht, sofern grundlegende Sicherheits- und Leistungsstandards erfüllt sind.
Ein weiterer Vorteil des US-Ansatzes ist das Pre-Cert-Programm. Dieses Programm erlaubt es vertrauenswürdigen Herstellern, ihre KI-Systeme kontinuierlich zu verbessern und Updates einzuspielen, ohne jedes Mal ein vollständiges Zulassungsverfahren durchlaufen zu müssen. Diese Flexibilität erleichtert insbesondere die Weiterentwicklung von maschinellen Lernsystemen.
Im Vergleich zum europäischen Ansatz zeigt sich der US-Regulierungsrahmen insgesamt anpassungsfähiger, was die Unterschiede zwischen beiden Systemen deutlich macht.
Vergleich der Regulierungsrahmen
Die verschiedenen Ansätze der EU und der USA haben direkte Auswirkungen auf die Praxis:
| Aspekt | Europäische Union | Vereinigte Staaten |
|---|---|---|
| Regulierungsstrenge | Sehr hoch – umfassende Dokumentation und Transparenz erforderlich | Flexibler – risikobasierte Anpassung der Anforderungen |
| Zulassungsdauer | Längere Zulassungsprozesse | Beschleunigte Verfahren (z. B. 510(k)) |
| Transparenzanforderungen | Detaillierte Dokumentation, inklusive Algorithmen-Erklärbarkeit | Fokus auf klinischer Leistung und Sicherheit |
| Post-Market-Überwachung | Kontinuierliche Berichterstattung und Risikoanalysen | Meldung unerwünschter Ereignisse und regelmäßige Updates |
| Iterative Verbesserungen | Wesentliche Änderungen benötigen neue Zulassungen | Kontinuierliche Updates durch Pre-Cert-Programm möglich |
Diese Unterschiede haben praktische Folgen für Hersteller und Anwender. Europäische Unternehmen müssen oft mehr in Compliance investieren, profitieren jedoch von einem einheitlichen Markt mit rund 450 Millionen Verbrauchern. In den USA können Produkte meist schneller eingeführt werden, was eine schnellere Anpassung an technologische Entwicklungen erlaubt.
Auch bei Investitionen gibt es Unterschiede: Während die USA traditionell hohe Summen in KI im Gesundheitswesen investieren, legt Europa zunehmend Wert auf eine verantwortungsvolle Entwicklung von KI. Europäische Standards gelten oft als Maßstab für globale Produkte und genießen einen hohen Ruf, was Vertrauen schafft.
Diese internationalen Ansätze liefern wertvolle Erkenntnisse, die auch in Deutschland in regulatorische und ethische Diskussionen einfließen. Sie zeigen, wie unterschiedlich der Umgang mit KI gestaltet werden kann und welche Vor- und Nachteile damit verbunden sind.
KI in der Klinik: Revolution oder Risiko?
Deutschlands regulatorische und ethische Anforderungen
Deutschland orientiert sich an internationalen Standards, passt diese jedoch an nationale Gegebenheiten an, um spezifische Anforderungen zu erfüllen.
Wie Deutschland EU-Verordnungen umsetzt
Deutschland integriert die EU-Standards in seine Gesetzgebung und ergänzt sie durch strengere nationale Vorschriften. Besonders im Gesundheitswesen müssen Anbieter sowohl die EU-weiten Regelungen als auch die nationalen Anforderungen berücksichtigen. Zu den zentralen Vorgaben zählen die Datenschutz-Grundverordnung (DSGVO), die Medizinprodukteverordnung und spezielle Strahlenschutzrichtlinien. Diese Regelwerke sollen sicherstellen, dass der Einsatz von KI in der Radiologie sowohl die Patientensicherheit gewährleistet als auch eine hohe diagnostische Qualität bietet.
Datenschutz und Ethik
Der Schutz von Patientendaten hat höchste Priorität, weshalb die DSGVO eine zentrale Rolle spielt. Sie verlangt, dass Patientendaten entweder auf einer klaren rechtlichen Grundlage oder mit ausdrücklicher Einwilligung verarbeitet werden. Allerdings erschwert der geringe Digitalisierungsgrad im deutschen Gesundheitswesen – etwa durch isolierte Datenspeicher (Datensilos) – die Integration und den Austausch von Daten zwischen verschiedenen Systemen. Solche Hürden können zu Problemen bei der Interoperabilität von KI-Lösungen führen. Zudem bergen unausgewogene oder fehlerhafte Datensätze das Risiko ungenauer KI-Ergebnisse, was die praktische Nutzbarkeit einschränken kann [1][2][3]. Diese strengen Datenschutz- und Ethikrichtlinien bilden jedoch die Grundlage für eine sichere und verantwortungsvolle Nutzung von KI in der klinischen Praxis.
Herausforderungen bei der klinischen Integration
Die Einführung von KI in der Radiologie ist mit erheblichen Schwierigkeiten verbunden. Obwohl zahlreiche KI-Systeme bereits zugelassen sind, ist ihre tatsächliche Anwendung in der Praxis oft begrenzt. Viele dieser Systeme sind stark spezialisiert und lassen sich nur schwer in bestehende Arbeitsabläufe oder IT-Strukturen integrieren. Dies führt häufig zu einem erhöhten Schulungsbedarf für das medizinische Personal [1][2]. Hinzu kommt die Komplexität der regulatorischen Anforderungen, die neben der DSGVO auch die Medizinprodukteverordnung und nationale Strahlenschutzvorschriften umfassen. Diese erfordern eine erhebliche administrative Anpassungsleistung [1][2][3]. Ein weiteres Hindernis sind technische Herausforderungen: Manche KI-Systeme benötigen spezielle Datenformate oder zusätzliche Arbeitsschritte, die den Routinebetrieb erheblich beeinträchtigen können.
sbb-itb-49a712f
Auswirkungen auf Innovation und zukünftige Entwicklungen
Die regulatorischen Rahmenbedingungen spielen eine zentrale Rolle für die Innovationskraft von KI in der deutschen Radiologie. Sie schaffen klare Vorgaben und sorgen für stabile Marktbedingungen, die Sicherheit und Fortschritt gleichermaßen fördern. Gleichzeitig lenken sie den Blick auf kommende Entwicklungen und Herausforderungen.
Innovation trotz regulatorischer Vorgaben
Auch innerhalb strenger Regularien finden Entwickler Wege, um Fortschritt voranzutreiben. Deutsche Start-ups und mittelständische Unternehmen setzen auf clevere Ansätze, um trotz komplexer Vorschriften erfolgreich zu sein. Testumgebungen bieten die Möglichkeit, KI-Lösungen in kontrollierten Szenarien zu erproben, bevor alle regulatorischen Anforderungen vollständig erfüllt werden müssen.
Ein häufiger Ansatz ist die Nutzung modularer Systeme, bei denen einzelne KI-Komponenten separat zertifiziert werden. Das reduziert nicht nur Kosten, sondern beschleunigt auch die Markteinführung. Besonders erfolgreich sind Unternehmen, die von Anfang an Datenschutzkonzepte wie Privacy by Design in ihre Architektur integrieren und so regulatorische Hürden von Beginn an berücksichtigen.
Ein weiterer Erfolgsfaktor ist die enge Zusammenarbeit zwischen Forschung und Industrie. Universitätskliniken nehmen hier oft eine Vermittlerrolle ein, indem sie akademische Forschung mit praxisnahen Anwendungen verbinden. Das Ergebnis: Lösungen, die wissenschaftliche Standards erfüllen und gleichzeitig den regulatorischen Anforderungen gerecht werden.
Veränderungen in der KI-Regulierung
Die regulatorischen Rahmenbedingungen entwickeln sich stetig weiter, getrieben von technologischen Neuerungen und praktischen Erfahrungen. Generative KI und adaptive Algorithmen stellen dabei besondere Herausforderungen dar, da sie sich nach ihrer Zulassung weiterentwickeln können.
Ergänzungen des EU AI Act, die speziell auf selbstlernende Systeme abzielen, schaffen neue Anforderungen für die kontinuierliche Überwachung und Validierung solcher Technologien. Ein weiteres großes Thema ist die Harmonisierung der Zulassungsverfahren innerhalb der EU. Besonders kleinere Unternehmen könnten von einheitlichen Prozessen profitieren, da sie bisher für jeden Markt separate Verfahren durchlaufen müssen.
Auch die Frage der Haftung bei KI-gestützten Diagnosen gewinnt an Bedeutung. Zukünftige Regelungen sollen klarstellen, wer im Falle fehlerhafter Diagnosen – ob Hersteller, Arzt oder Klinik – verantwortlich ist. Diese Klärung wird nicht nur mehr Rechtssicherheit schaffen, sondern auch das Vertrauen in KI-Lösungen stärken.
Perspektiven für die KI in der Radiologie
Die Anpassung der Regulierungen wird die Dynamik des radiologischen Marktes entscheidend beeinflussen. Flexiblere Ansätze, die sich an technologische Entwicklungen anpassen können, werden immer wichtiger.
Ein spannender Trend ist die Einführung von Qualitätssiegeln für KI-Systeme, die über die Mindestanforderungen hinausgehen. Solche freiwilligen Zertifizierungen könnten Kliniken helfen, besonders leistungsfähige und vertrauenswürdige Lösungen zu identifizieren.
Darüber hinaus wird erwartet, dass Real-World-Evidence – also Daten aus dem klinischen Alltag – eine größere Rolle bei der Bewertung von KI-Systemen spielen wird. Diese Daten könnten helfen, die tatsächliche Leistungsfähigkeit von Anwendungen besser einzuschätzen und schneller auf mögliche Probleme zu reagieren.
Dr. Sven Jungmann bietet Vorträge und Beratungen zu diesen Themen an. Sein Fokus liegt auf praxisnahen Einblicken in die Anwendung von KI im Gesundheitswesen und dem Management technologischer Transformationen. Seine Expertise hilft Organisationen, die Balance zwischen regulatorischen Anforderungen und Innovation zu finden.
Der Schlüssel für die Zukunft wird darin liegen, die regulatorischen Vorgaben stetig an die technologische Realität anzupassen, ohne die hohen Sicherheitsstandards aus den Augen zu verlieren.
Fazit: Zentrale Erkenntnisse und praktische Handlungsempfehlungen
Die Regulierung von KI in der Radiologie beeinflusst sowohl die Sicherheit der Patienten als auch den Fortschritt in der Technologie. Mit dem EU AI Act und der MDR setzen Deutschland und Europa klare Rahmenbedingungen, deren Erfolg sich in der praktischen Umsetzung zeigt. Die große Herausforderung besteht darin, wie gut alle Beteiligten die komplexen Anforderungen bewältigen.
Zentrale Erkenntnisse im Überblick
Drei Hauptprinzipien prägen die KI-Regulierung in der Radiologie: Patientensicherheit, Datenschutz und klinische Wirksamkeit. Diese Prinzipien ziehen sich durch sämtliche Ebenen – von den europäischen Gesetzen bis hin zur Anwendung in deutschen Gesundheitseinrichtungen.
Ein auffälliger Punkt ist die ungleiche Ausgangslage zwischen großen Technologieunternehmen und kleineren Innovatoren. Während Konzerne die Ressourcen haben, um aufwendige Zulassungsverfahren zu durchlaufen, stehen Start-ups oft vor erheblichen Hürden. Diese Ungleichheit könnte langfristig die Vielfalt an KI-Lösungen einschränken.
Interessant ist auch der Vergleich zwischen Europa und den USA. Während die FDA in den USA auf risikobasierte Ansätze setzt, verfolgt Europa einen umfassenderen Weg, der auch ethische und gesellschaftliche Aspekte stärker in den Fokus rückt. Diese Unterschiede werden immer wichtiger, da KI-Systeme zunehmend global entwickelt und vertrieben werden.
Aus diesen Erkenntnissen lassen sich klare Maßnahmen ableiten.
Praktische Handlungsempfehlungen
Radiologen und Klinikbetreiber sollten frühzeitig Pilotprojekte starten und eng mit Herstellern zusammenarbeiten, anstatt auf vollständig ausgereifte Produkte zu warten. Die dabei gesammelten Erfahrungen können später bei der regulären Einführung von großem Nutzen sein.
Technologieunternehmen sollten Compliance von Anfang an in ihre Entwicklungsprozesse integrieren. Privacy by Design und explainable AI sind keine Extras, sondern Pflichtanforderungen für den europäischen Markt. Unternehmen, die diese Prinzipien frühzeitig umsetzen, können sich einen deutlichen Vorsprung sichern.
Für Gesundheitspolitiker ist es entscheidend, die richtige Balance zwischen Sicherheit und Fortschritt zu finden. Zu strenge Vorgaben könnten Deutschland im internationalen Wettbewerb schwächen, während zu lockere Regeln das Vertrauen in KI gefährden könnten. Regelmäßige Überprüfungen und Anpassungen der bestehenden Regelwerke sind daher unverzichtbar.
Ausblick auf die weitere Entwicklung
Die kommenden Jahre werden entscheidend für die Zukunft der KI in der Radiologie. Ein bedeutender Wandel zeichnet sich durch die Einführung von Real-World-Evidence als Bewertungsmaßstab ab. Statt ausschließlich auf klinische Studien zu setzen, gewinnen kontinuierliche Leistungsdaten aus dem Alltag an Bedeutung.
Ein weiteres Ziel ist die Harmonisierung der Zulassungsverfahren innerhalb der EU. Eine erfolgreiche Umsetzung würde vor allem kleineren Unternehmen zugutekommen und die Innovationskraft in Europa stärken. Gleichzeitig arbeiten Regulierungsbehörden an flexibleren Modellen für adaptive und selbstlernende Systeme.
Dr. Sven Jungmann unterstützt Organisationen dabei, diese komplexen regulatorischen Herausforderungen zu bewältigen. Mit seiner Expertise in digitaler Gesundheit und KI-Anwendungen hilft er, umsetzbare Strategien zu entwickeln, die den Anforderungen gerecht werden und gleichzeitig Raum für Innovation lassen.
Die Zukunft der KI in der Radiologie hängt davon ab, wie effektiv Sicherheit und Fortschritt miteinander verbunden werden. Die Basis ist gelegt – jetzt kommt es auf eine kluge Umsetzung an.
FAQs
Wie unterscheiden sich die Regulierungen für KI in der Radiologie zwischen der EU und den USA?
Die EU und die USA gehen bei der Regulierung von KI in der Radiologie unterschiedliche Wege. Der EU AI Act verfolgt einen strengen, risikobasierten Ansatz. Dieser verlangt umfassende Prüfungen, insbesondere für KI-Systeme, die als hochriskant eingestuft werden. In den USA hingegen setzt die FDA auf einen flexibleren Ansatz, der stärker auf Daten basiert. Ziel ist es, Innovationen durch schnellere Zulassungsverfahren zu ermöglichen.
Ein konkretes Beispiel dafür ist der Einsatz von „Pre-Determined Change Control Plans“ (PCCPs) durch die FDA. Diese Pläne erlauben es Herstellern, geplante Updates für Algorithmen im Voraus zu definieren, wodurch kontinuierliche Verbesserungen zügiger umgesetzt werden können. Im Gegensatz dazu schreibt der EU AI Act vor, dass Änderungen an hochriskanten KI-Systemen erst nach einer Genehmigung durch benannte Stellen vorgenommen werden dürfen.
Welche Rolle spielen Datenschutz- und Ethikrichtlinien bei der Nutzung von KI in der Radiologie in Deutschland?
Die Anwendung von KI in der Radiologie in Deutschland steht unter dem Einfluss der Datenschutz-Grundverordnung (DSGVO) sowie strenger ethischer Vorgaben. Der Umgang mit sensiblen Patientendaten verlangt äußerste Vorsicht, um Datenschutz und Datensicherheit sicherzustellen.
Werte wie Transparenz, Gerechtigkeit und das Vertrauen der Patienten spielen dabei eine zentrale Rolle. Die Bundesärztekammer betont die Bedeutung klarer ethischer Richtlinien und eines stabilen rechtlichen Rahmens, um den Einsatz von KI in der Medizin sicher und verantwortungsvoll zu gestalten.
Welche Hürden gibt es bei der Einführung von KI in der Radiologie und wie können sie gemeistert werden?
Die Einführung von KI-Systemen in der Radiologie bringt einige Herausforderungen mit sich. Ein zentraler Punkt sind die regulatorischen Vorgaben, wie die europäische Medizinprodukteverordnung (MDR) und die Verordnung über In-vitro-Diagnostika (IVDR). Diese Regelungen sollen sicherstellen, dass KI-gestützte Medizinprodukte sowohl sicher als auch wirksam sind. Darüber hinaus spielt der Datenschutz eine entscheidende Rolle. Insbesondere bei sensiblen Patientendaten müssen die Anforderungen der DSGVO strikt eingehalten werden.
Ein weiteres Problemfeld ist der Mangel an digitalen Kompetenzen im Gesundheitswesen. Die Bundesärztekammer betont die Bedeutung von Aus-, Weiter- und Fortbildungsangeboten, um Ärztinnen und Ärzte auf den Umgang mit KI-Technologien vorzubereiten. Nur mit fundiertem Wissen können sie die Potenziale und Risiken solcher Systeme richtig bewerten und anwenden.
Mit klar definierten rechtlichen Rahmenbedingungen, einem starken Fokus auf den Schutz von Patientendaten und gezielten Schulungen für medizinisches Personal lässt sich die Integration von KI in der Radiologie erfolgreich umsetzen.
Verwandte Blogbeiträge
- KI-Implementierung: Häufige Fragen beantwortet
- Ärzte vs. Patienten: Vertrauen in KI aus zwei Perspektiven
- AI-gestützte Risikostratifizierung im Gesundheitswesen
- Integration von KI-Diagnostik in klinische Abläufe
Förderstrategien für Startups im Digital-Health-Bereich
Digital-Health-Startups in Deutschland stehen vor großen Herausforderungen: Finanzierung, regulatorische Anforderungen und lange Entwicklungszyklen. Doch es gibt viele Fördermöglichkeiten, die helfen können, diese Hürden zu überwinden. Hier sind die wichtigsten Punkte zusammengefasst:
- Warum Finanzierung entscheidend ist: Entwicklung, Tests und Markteintritt erfordern hohe Investitionen. Regulatorische Hürden wie CE-Kennzeichnungen oder klinische Studien machen zusätzliche Mittel notwendig.
- Fördermöglichkeiten in Deutschland und der EU: Von staatlichen Zuschüssen wie KMU-innovativ bis zu EU-Programmen wie Horizon Europe gibt es zahlreiche Optionen. Diese bieten nicht nur Kapital, sondern oft auch Netzwerke und Beratung.
- Tipps zur Antragstellung: Ein klarer Businessplan, realistische Zeitpläne und Marktvalidierungen sind entscheidend. Fehler wie unklare Konkurrenzanalysen oder unvollständige Unterlagen sollten vermieden werden.
- Unterstützungsangebote: Acceleratoren, Wettbewerbe und Mentoring-Programme wie EIT Health oder regionale Wirtschaftsförderungen bieten zusätzliche Hilfe.
Mit einer gezielten Strategie und der richtigen Unterstützung können Startups ihre Ideen erfolgreich umsetzen und langfristig wachsen.
Pressekonferenz: Veröffentlichung der Digital Health Startup-Umfrage
Deutschlands Digital-Health-Förderungslandschaft
In Deutschland gibt es eine Vielzahl von Fördermöglichkeiten für Digital-Health-Startups, sowohl auf nationaler Ebene als auch durch EU-Finanzierungen. Das Land gilt als Vorreiter im europäischen Digital-Health-Markt. Wer die verschiedenen Programme versteht, kann gezielt die passenden Förderungen auswählen und so seine Erfolgschancen erheblich steigern. Wie bereits erwähnt, spielen Fördermittel eine zentrale Rolle beim Markteintritt. Um diese optimal zu nutzen, sollte man sich mit den grundlegenden Begriffen vertraut machen.
Grundbegriffe und Definitionen
Zuschüsse sind finanzielle Mittel, die in der Regel von staatlichen Institutionen oder der EU bereitgestellt werden. Das Besondere: Sie müssen nicht zurückgezahlt werden und erfordern keine Unternehmensbeteiligung, was sie besonders attraktiv macht.
Wettbewerbe bieten Startups nicht nur Preisgelder, sondern auch eine Plattform, um Sichtbarkeit zu erlangen – ebenfalls ohne eine Abgabe von Unternehmensanteilen.
Bei der Eigenkapitalfinanzierung hingegen investieren Geldgeber in ein Unternehmen und erhalten im Gegenzug Anteile daran. Öffentlich-private Partnerschaften verbinden staatliche Förderungen mit privaten Investitionen. Diese Kombination ist besonders im Gesundheitswesen relevant, wo öffentliche Interessen auf kommerzielle Innovationen treffen.
Ein weiterer wichtiger Begriff ist die Anschlussfinanzierung. Digital-Health-Projekte durchlaufen oft mehrere Entwicklungsphasen, in denen wiederholt Kapital benötigt wird. Viele Förderprogramme sind darauf ausgelegt, Startups über verschiedene Entwicklungsstufen hinweg zu begleiten.
Ausrichtung an nationalen und EU-Prioritäten
Mit diesen Grundbegriffen im Hinterkopf lassen sich Förderkriterien besser verstehen, insbesondere im Kontext nationaler und europäischer Prioritäten. Sowohl Deutschland als auch die EU haben klare Schwerpunkte in der Digital-Health-Förderung gesetzt. Startups, die ihre Projekte an diesen Prioritäten ausrichten, erhöhen ihre Förderchancen.
Die Bundesregierung legt besonderen Wert auf Themen wie künstliche Intelligenz im Gesundheitswesen, Telemedizin und patientenorientierte Lösungen. Mit der Digitalen Agenda 2025 verfolgt Deutschland das Ziel, ein führender Standort für digitale Gesundheit zu werden. Projekte, die die Patientenversorgung verbessern oder die Effizienz im Gesundheitssystem steigern, stehen dabei im Fokus. Besonders gefragt sind Ansätze, die Herausforderungen wie den demografischen Wandel oder die medizinische Versorgung in ländlichen Regionen adressieren.
Auf EU-Ebene liegt der Schwerpunkt auf Interoperabilität und grenzüberschreitenden Gesundheitsdiensten. Startups, die Lösungen für den sicheren Datenaustausch oder die Standardisierung von Gesundheitsdaten entwickeln, haben hier besonders gute Chancen auf Förderung.
Auch nachhaltige Lösungen im Digital-Health-Bereich stehen hoch im Kurs. Dazu zählen Ansätze, die Ressourcen schonen oder umweltfreundliche Alternativen zu herkömmlichen Behandlungsmethoden bieten, wie etwa die Reduzierung von Krankenhausaufenthalten oder die Optimierung von Medikamentenlogistik.
Ein weiterer zentraler Punkt ist die Cybersicherheit. Angesichts der zunehmenden Bedrohung durch Cyberangriffe auf Gesundheitseinrichtungen fördern Deutschland und die EU verstärkt Projekte, die digitale Gesundheitssysteme sicherer machen. Startups mit innovativen Ansätzen zur IT-Sicherheit im Gesundheitssektor können hier auf großes Interesse stoßen.
Staatliche Zuschüsse und öffentliche Förderprogramme
Deutschland und die EU bieten zahlreiche Fördermöglichkeiten, die Startups im Bereich Digital Health von der ersten Idee bis zur Marktreife unterstützen können. Diese Programme unterscheiden sich in Zielsetzung, Förderhöhe und Zielgruppe. Wer sich gut informiert, kann gezielt das passende Programm auswählen und seine Chancen auf eine erfolgreiche Förderung erhöhen.
KMU-innovativ: Interaktive Technologien für Gesundheit und Lebensqualität
Das Bundesministerium für Bildung und Forschung (BMBF) hat mit „KMU-innovativ: Interaktive Technologien für Gesundheit und Lebensqualität“ ein Förderprogramm speziell für kleine und mittlere Unternehmen (KMU) entwickelt. Es richtet sich an Unternehmen, die innovative Technologien für digitale Gesundheit und Pflege entwickeln. Besonders attraktiv: Die Förderung erfolgt in Form eines nicht rückzahlbaren Zuschusses – ein großer Vorteil, gerade in der frühen Entwicklungsphase.
In der Regel übernimmt das Programm 50 % der förderfähigen Kosten. Für KMU gibt es oft zusätzliche Boni. Universitäten, die an Projekten beteiligt sind, können sogar bis zu 100 % der Kosten gefördert bekommen – plus eine Projektpauschale von 20 % bei nicht-kommerziellen Vorhaben.
Die Laufzeit der Projekte beträgt üblicherweise bis zu drei Jahre, was ausreichend Zeit für die Entwicklung und Erprobung bietet. Der Antragsprozess ist zweistufig: Zuerst wird eine Projektskizze bei der VDI/VDE Innovation + Technik GmbH eingereicht. Nach einer positiven Bewertung folgt der formelle Antrag. Wichtig: Die Fristen für die Einreichung der Projektskizzen sind der 15. April und der 15. Oktober. Diese festen Termine erleichtern eine strukturierte Planung.
EU-Programme: Digital Europe Programme und Horizon Europe
Auch auf europäischer Ebene gibt es umfangreiche Fördermöglichkeiten für Digital-Health-Startups. Im Rahmen von Horizon Europe stellt die Europäische Kommission über 14 Milliarden Euro für digitale Gesundheitsprojekte bereit[1]. Anders als nationale Förderungen, die oft auf das heimische Ökosystem fokussiert sind, fördern EU-Programme grenzüberschreitende Kooperationen und groß angelegte Innovationen.
Ein Beispiel ist der EIC Accelerator, eines der bekanntesten EU-Förderprogramme. Er bietet nicht nur finanzielle Unterstützung, sondern auch Zugang zu europäischen Märkten und Netzwerken. Allerdings ist die Konkurrenz hoch, und die Antragsverfahren sind komplexer als bei nationalen Programmen.
Vergleich der Förderprogramme
Ein direkter Vergleich der Programme hilft dabei, die richtige Wahl zu treffen:
| Programm | Förderhöhe | Laufzeit | Zielgruppe | Kofinanzierung | Besonderheiten |
|---|---|---|---|---|---|
| KMU-innovativ (BMBF) | 50–100 % der förderfähigen Kosten | Bis zu 3 Jahre | KMU und Forschungseinrichtungen | Ja (ca. 50 % für Unternehmen) | Zweistufiges Verfahren, feste Fristen |
| Horizon Europe | Mehrere Millionen € möglich | Variabel | Konsortien und größere Projekte | Ja | Grenzüberschreitende Kooperationen |
| EIC Accelerator | Variabel | Variabel | Innovative Startups | Teilweise | Zugang zu europäischen Märkten, hohe Konkurrenz |
Während nationale Programme oft durch einfachere Antragsverfahren und kürzere Bearbeitungszeiten punkten, bieten EU-Programme höhere Fördersummen und Zugang zu internationalen Märkten. Allerdings sind die Anforderungen oft komplexer, und internationale Partnerschaften sind meist Voraussetzung. Bei der Planung sollten Startups diese Unterschiede berücksichtigen, um den richtigen Zeitpunkt und das passende Programm für ihre Bedürfnisse zu wählen.
Acceleratoren, Wettbewerbe und Networking-Optionen
Acceleratoren, Wettbewerbe und Networking-Events eröffnen Digital-Health-Startups neue Wege für Finanzierung und Entwicklung. Diese Programme verbinden finanzielle Unterstützung mit Mentoring, Zugang zu Märkten und strategischen Partnerschaften. Für viele Gründer sind sie ein entscheidender Baustein für schnelles Wachstum und eine erfolgreiche Markteinführung. Sie ergänzen staatliche Förderprogramme und schaffen zusätzliche Möglichkeiten für Expansion.
Wichtige Acceleratoren und Wettbewerbe
EIT Health ist ein herausragendes pan-europäisches Netzwerk, das sich der Förderung von Healthtech-Startups widmet. Neben direkter finanzieller Unterstützung bietet EIT Health umfassende Mentoring-Programme und Zugang zu einem breiten Netzwerk aus Forschungseinrichtungen, Unternehmen und Bildungspartnern [2]. Besonders wertvoll ist die Möglichkeit, von Anfang an in einem internationalen Kontext zu agieren.
Die Programme von EIT Health unterstützen Gründer in entscheidenden Phasen wie Ideenentwicklung, Co-Founder-Matching und Vorbereitung auf Fundraising. Zusätzlich eröffnen sie den Zugang zu Founder-Communities, die den Austausch mit Gleichgesinnten, Zusammenarbeit und geteilte Ressourcen fördern [2].
Neben solchen Initiativen spielen auch Venture-Capital-Firmen eine wichtige Rolle. Sie bieten nicht nur finanzielle Mittel, sondern auch strategische Beratung und Zugang zu Branchenkontakten, was die bestehenden Fördermöglichkeiten sinnvoll ergänzt.
Networking-Events: Schlüssel zu wertvollen Kontakten
Während Acceleratoren und Wettbewerbe gezielte Unterstützung bieten, eröffnen Networking-Events den Zugang zu wichtigen Branchenkontakten. Branchenspezifische Veranstaltungen und Networking-Events sind essenziell, um im Digital-Health-Ökosystem Fuß zu fassen. Sie ermöglichen Startups, schneller zu wachsen und fördern eine kooperative Kultur, die über reine Konkurrenz hinausgeht [3].
Ein bemerkenswerter Trend: Venture-to-Venture-Partnerschaften haben 2024 einen Anstieg auf 40 % verzeichnet [3]. Solche Partnerschaften stärken Startups, indem sie Ressourcen bündeln, die Produktentwicklung beschleunigen und die Markteinführung erleichtern. Besonders hilfreich ist die gemeinsame Bewältigung regulatorischer Hürden, die für einzelne Startups oft schwierig zu meistern sind.
Für Startups, die grenzüberschreitende Kooperationen anstreben, bieten Networking-Events eine Plattform, um Konsortien zu bilden. Kontakte können über nationale Kontaktstellen oder Plattformen wie CORDIS geknüpft werden [1]. Solche Partnerschaften sind oft eine Voraussetzung für die erfolgreiche Bewerbung bei größeren EU-Förderprogrammen.
Die Teilnahme an diesen Veranstaltungen sollte gut geplant sein. Startups profitieren am meisten, wenn sie aktiv das Digital-Health-Ökosystem mitgestalten und auf Kooperation statt Wettbewerb setzen [3]. Dieser kollaborative Ansatz hat sich als effektiver Weg erwiesen, um schneller zu wachsen und bessere Marktchancen zu nutzen.
Branchenspezifische Organisationen und Programme bieten nicht nur Mentoring und Unterstützung bei der Skalierung, sondern auch direkte Verbindungen zu Schlüsselakteuren aus Forschung, Wirtschaft und Bildung. Diese Kontakte sind entscheidend, um Wachstum zu sichern und Investoren zu gewinnen [2].
sbb-itb-49a712f
So erstellen Sie eine erfolgreiche Förderantragstellung
Die Qualität Ihrer Förderantragstellung kann über die Finanzierung Ihres Projekts entscheiden. Eine gründliche Vorbereitung und eine professionelle Präsentation sind dabei entscheidend. Hier erfahren Sie, wie Sie Ihren Businessplan und Ihr Pitch Deck überzeugend gestalten und welche Unterstützungsmöglichkeiten Sie nutzen können.
Effektiven Businessplan und Pitch Deck erstellen
Ihr Businessplan ist das Herzstück Ihres Antrags. Er sollte Ihre Vision klar darlegen, mit präzisen Marktdaten untermauert sein, realistische Finanzprognosen enthalten und eine konkrete Umsetzungsstrategie bieten. Gerade bei Digital-Health-Projekten erwarten Fördergeber detaillierte regulatorische Planungen.
Um den Bedarf Ihres Projekts zu belegen, sind praktische Nachweise wie Nutzerinterviews, Pilotprojekte oder Prototyp-Tests überzeugender als rein theoretische Analysen. Solche Marktvalidierungen zeigen, dass Ihre Idee auf realen Bedürfnissen basiert.
Die finanzielle Planung sollte transparent und nachvollziehbar sein. Denken Sie an alle relevanten Kosten, von der Entwicklung über Zulassungsverfahren bis hin zur Markteinführung. Besonders regulatorische Aufwendungen werden von Startups häufig unterschätzt – ein häufiger Grund für Ablehnungen.
Ihr Pitch Deck sollte die Kernelemente des Businessplans auf 10 bis 15 prägnante Folien reduzieren. Beginnen Sie mit der Problemstellung und zeigen Sie klar, welchen Nutzen Ihre Lösung für Patienten oder das Gesundheitssystem bietet. Setzen Sie visuelle Elemente gezielt ein, um Ihre Aussagen zu unterstreichen, ohne abzulenken.
Unterstützungsdienste und Mentoring nutzen
Externe Experten können eine wertvolle Hilfe bei der Antragstellung sein. Sie bieten nicht nur fachliche Unterstützung, sondern helfen auch, typische Fehler zu vermeiden.
- BioRN: Dieser bekannte Biotech-Cluster in Deutschland bietet Digital-Health-Startups umfassende Beratung. Die Experten dort kennen die Anforderungen verschiedener Förderprogramme und können Ihre Unterlagen gezielt optimieren.
- EIT Health Community: Neben finanzieller Unterstützung bietet EIT Health erfahrenes Mentoring. Branchenexperten, die selbst erfolgreiche Anträge gestellt haben, helfen Ihnen, Schwachstellen zu identifizieren und gezielt zu verbessern.
- Regionale Wirtschaftsförderungen: Viele bieten kostenlose Beratungsgespräche an. Auch wenn sie nicht speziell auf Digital-Health-Projekte ausgerichtet sind, kennen sie die formalen Anforderungen und können wertvolle Hinweise geben.
- Technology Transfer Offices: Universitäten und Forschungseinrichtungen verfügen oft über solche Büros, die bei der Kommerzialisierung von Forschungsergebnissen helfen. Wenn Ihr Startup aus einem universitären Umfeld stammt, sollten Sie diese Ressourcen unbedingt nutzen.
Häufige Fehler vermeiden
Einige Fehler können selbst die besten Anträge scheitern lassen. Hier ein Überblick, worauf Sie achten sollten:
- Realistische Zeitpläne: Digital-Health-Projekte benötigen oft mehr Zeit, insbesondere bei regulatorischen Genehmigungen. Planen Sie ausreichend Pufferzeiten ein und kommunizieren Sie mögliche Verzögerungen frühzeitig.
- Klare Konkurrenzanalyse: Fördergeber erwarten eine präzise Einschätzung des Wettbewerbs. Aussagen wie „Es gibt keine Konkurrenz“ wirken unprofessionell. Zeigen Sie stattdessen, wie Ihre Lösung sich abhebt.
- Nachhaltigkeitsstrategie: Fördergeber möchten wissen, wie Ihr Unternehmen nach der Förderperiode bestehen bleibt. Entwickeln Sie einen Plan für Anschlussfinanzierungen und die Markteinführung.
- Formale Fehler vermeiden: Unvollständige Angaben, falsche Seitenzahlen, nicht eingehaltene Formatvorgaben oder verpasste Fristen können Ihren Antrag scheitern lassen. Prüfen Sie alle Anforderungen sorgfältig und lassen Sie den Antrag von einer unabhängigen Person gegenlesen.
Besonders wichtig ist, dass Ihr Antrag exakt auf das jeweilige Förderprogramm abgestimmt ist. Jedes Programm hat eigene Ziele und Kriterien. Ein Antrag für EXIST muss anders gestaltet sein als einer für Horizon Europe. Lesen Sie die Richtlinien genau und passen Sie Ihre Argumentation entsprechend an.
Expertenunterstützung für bessere Ergebnisse
Der Digital-Health-Sektor ist komplex, und für Startups kann es eine echte Herausforderung sein, alle verfügbaren Fördermöglichkeiten zu überblicken. Hier kommt professionelle Beratung ins Spiel: Experten können typische Fehler vermeiden und wissen genau, worauf verschiedene Fördergeber besonders Wert legen. Im nächsten Abschnitt zeigt Dr. Sven Jungmann, wie spezialisierte Beratung Ihr Förderprojekt gezielt voranbringen kann.
Von Dr. Sven Jungmann lernen
Dr. Sven Jungmann bringt wertvolle Einblicke in die Bereiche KI, Innovation und Digital Health mit. Seine Erfahrung hilft Startups, die digitale Transformation strategisch zu gestalten und technologische Entwicklungen erfolgreich zu nutzen.
Besonders hilfreich für Digital-Health-Startups sind seine praktischen Kenntnisse über technologische Entwicklungen und den Einsatz von KI im Gesundheitswesen. Diese Expertise ist ein echter Vorteil bei Förderanträgen, da Fördergeber zunehmend innovative Ansätze bevorzugen, die nachhaltige Verbesserungen im Gesundheitssystem bewirken. Seine praxisnahen Einblicke stärken die strategische Ausrichtung Ihrer Förderprojekte.
Dr. Jungmann bietet umfassende Beratungsleistungen für Startups und Investmentfirmen im Digital-Health-Bereich. Dabei deckt er Themen wie KI, Big Data und digitale Plattformen ab – Schlüsselthemen, die bei vielen Förderprogrammen im Fokus stehen. Seine Vorträge zum Innovationsmanagement zeigen, wie interne Prozesse so optimiert werden können, dass Fördermittel nicht nur erfolgreich beantragt, sondern auch effizient eingesetzt werden.
Bildungsressourcen für langfristigen Erfolg
Neben der direkten Beratung spielt kontinuierliche Weiterbildung eine entscheidende Rolle. In einem dynamischen Markt wie Digital Health ist aktuelles Wissen unverzichtbar. Workshops, Seminare und Fachkonferenzen bieten die Möglichkeit, immer auf dem neuesten Stand zu bleiben.
Besonders wertvoll sind Bildungsangebote, die sich auf die praktische Anwendung neuer Technologien konzentrieren. Es ist wichtig zu verstehen, wie technologische Entwicklungen Ihr Geschäftsmodell beeinflussen und wie Sie diese in Ihre Förderstrategie integrieren können. Solche Weiterbildungen helfen, die in der Beratung entwickelten Strategien langfristig umzusetzen.
Auch die Networking-Möglichkeiten bei Bildungsveranstaltungen sind von großem Nutzen. Sie bieten die Gelegenheit, andere Gründer, potenzielle Partner und Vertreter von Förderorganisationen kennenzulernen – Kontakte, die bei der Antragstellung entscheidend sein können.
Investitionen in branchenspezifische Zertifizierungen oder Kurse zu regulatorischen Anforderungen sind ebenfalls empfehlenswert. Digital-Health-Projekte müssen oft strenge Auflagen erfüllen, und entsprechende Qualifikationen im Team können Ihre Glaubwürdigkeit erheblich steigern. Die Teilnahme an internationalen Konferenzen ist eine weitere Möglichkeit, globale Trends frühzeitig zu erkennen und Ihr Projekt entsprechend auszurichten. Viele Förderprogramme bevorzugen Projekte, die über den nationalen Kontext hinaus Wirkung zeigen können.
Fazit: Ihr Weg zum Erfolg mit Fördermitteln im Digital-Health-Bereich
Die bisherigen Ausführungen zeigen, wie wichtig eine durchdachte Vorbereitung, eine klare politische Ausrichtung und professionelle Unterstützung sind. Der Schlüssel zum Erfolg bei der Beantragung von Fördermitteln im Bereich Digital Health liegt in drei Kernfaktoren:
- Strategische Vorbereitung
- Ausrichtung auf Förderkriterien
- Fachkundige Beratung
Strategische Vorbereitung bedeutet, dass Sie Ihr Geschäftsmodell präzise definieren, regulatorische Anforderungen berücksichtigen und eine fundierte Marktanalyse sowie einen realistischen Finanzplan vorlegen. Diese Aspekte sind entscheidend, wie es auch in den vorgestellten Förderprogrammen deutlich wird.
Die Ausrichtung auf Förderkriterien ist ein weiterer zentraler Faktor. Förderprogramme wie Horizon Europe und Digital Europe konzentrieren sich darauf, die digitale Souveränität Europas zu stärken und gesellschaftliche Herausforderungen zu bewältigen. Ihr Antrag sollte klar darlegen, wie Ihre Innovation diese Ziele unterstützt und einen echten Mehrwert bietet.
Fachkundige Beratung kann oft den entscheidenden Unterschied ausmachen. Experten wie Dr. Sven Jungmann unterstützen Startups dabei, ihre Projekte strategisch zu positionieren. Besonders in den Bereichen Künstliche Intelligenz, digitale Innovationen und Gesundheitswesen bringt seine Expertise einen großen Vorteil, da diese Themen in vielen Förderprogrammen im Mittelpunkt stehen.
Der Digital-Health-Markt in Deutschland bietet enorme Chancen für gut vorbereitete Startups. Mit der richtigen Mischung aus innovativer Technologie, strategischer Planung und professioneller Unterstützung können Sie Fördermittel erfolgreich sichern. Nutzen Sie die vorhandenen Ressourcen und Netzwerke – Ihr Projekt hat das Potenzial, einen bedeutenden Einfluss auf das Gesundheitswesen zu nehmen.
FAQs
Welche Hürden müssen Digital-Health-Startups in Deutschland bei der Beantragung von Fördermitteln bewältigen?
Digital-Health-Startups in Deutschland stehen vor einigen Hürden, wenn es darum geht, Fördermittel zu sichern. Eine der größten Herausforderungen ist das komplizierte Förderumfeld. Die Antragsverfahren sind oft zeitaufwendig und mit spezifischen Anforderungen verbunden, die eine gründliche Vorbereitung nötig machen. Besonders in der Wachstumsphase fehlt es häufig an ausreichenden Series-A-Investitionen, was die Möglichkeit, über den deutschen Markt hinaus zu expandieren, deutlich einschränkt.
Ein weiteres Problem ist die starke Abhängigkeit von öffentlichen Fördergeldern. Diese gehen oft mit langsamen Entscheidungsprozessen und strengen Regularien einher. Dadurch sind Startups gezwungen, kreative Ansätze zu entwickeln, um ihre Projekte überzeugend zu präsentieren und die passenden Förderprogramme gezielt auszuwählen.
Wie können Startups im Digital-Health-Bereich ihre Projekte an nationale und EU-Prioritäten anpassen, um bessere Chancen auf Fördermittel zu haben?
Startups im Bereich Digital Health können ihre Chancen auf Fördermittel erheblich steigern, wenn sie ihre Projekte gezielt an den Prioritäten von nationalen und EU-Programmen ausrichten. Dabei spielen einige zentrale Punkte eine Rolle:
- Passende Förderprogramme identifizieren: Das Bundesministerium für Bildung und Forschung (BMBF) bietet Förderungen in Bereichen wie digital unterstützter Gesundheit, Pflege und Technologien zur Steigerung der Lebensqualität an. Besonders kleine und mittlere Unternehmen (KMU) können von speziell zugeschnittenen Zuschüssen profitieren.
- Förderrichtlinien genau beachten: Es ist entscheidend, die Vorgaben der jeweiligen Programme sorgfältig zu prüfen und Projektanträge entsprechend anzupassen. Häufig sind zweistufige Verfahren mit festen Fristen für die Einreichung von Projektskizzen vorgesehen.
- EU-Kriterien berücksichtigen: KMU, die den EU-Kriterien entsprechen, können sich zusätzliche Vorteile wie Bonuszahlungen sichern. Eine genaue Prüfung dieser Anforderungen kann sich daher lohnen.
Eine gründliche Vorbereitung und die präzise Ausrichtung Ihrer Projekte an den jeweiligen Vorgaben können den entscheidenden Unterschied machen, um die benötigten Fördermittel zu erhalten.
Wie können Netzwerke und Mentoring-Programme wie EIT Health Digital-Health-Startups unterstützen?
Netzwerke und Mentoring-Programme wie EIT Health spielen eine zentrale Rolle für Digital-Health-Startups. Sie ermöglichen Zugang zu Expertenwissen, eröffnen Türen zu neuen Märkten und schaffen Verbindungen zu potenziellen Investoren. Durch den Austausch mit erfahrenen Mentoren und anderen Innovatoren können Startups ihre Geschäftsideen verfeinern und effizienter in die Tat umsetzen.
EIT Health bietet gezielte Programme, die speziell darauf ausgerichtet sind, neue Lösungen im Gesundheitsbereich zu entwickeln. Neben praktischer Unterstützung schaffen diese Programme eine Plattform, um mit wichtigen Akteuren der Branche in Kontakt zu treten und langfristige Partnerschaften aufzubauen.
Verwandte Blogbeiträge
- Wie KI Gesundheitsorganisationen transformiert
- Studie: Zukunftstrends bei digitalen Kompetenzen im Gesundheitswesen
- Wie man Innovationserfolg mit KPIs misst
- AI in Healthcare: Skalierung jenseits von Pilotprojekten
Integration von KI-Diagnostik in klinische Abläufe
Die Integration von KI-Diagnostik verändert die medizinische Praxis in Deutschland grundlegend. KI-Systeme analysieren medizinische Daten wie Bilder und Laborergebnisse, um präzisere und schnellere Diagnosen zu ermöglichen. Gleichzeitig entlasten sie das Personal, reduzieren Fehler und verbessern die Patientenversorgung. Doch der Einsatz erfordert eine leistungsfähige IT-Infrastruktur, strenge Einhaltung von Datenschutz- und Regulierungsstandards sowie umfassende Schulungen für das Personal.
Kernpunkte:
- Vorteile: Präzisere Diagnosen, Zeitersparnis, Fehlerreduktion, Entlastung des Personals.
- Technische Anforderungen: Dateninteroperabilität (z. B. HL7 FHIR), leistungsstarke IT-Systeme, Cybersicherheit.
- Regulierung: MDR, DSGVO und EU-KI-Verordnung stellen hohe Anforderungen an Sicherheit und Transparenz.
- Ethische Aspekte: Nachvollziehbarkeit der KI-Entscheidungen, Schutz der Patientendaten, Vermeidung von Bias.
- Einführung: Schrittweise Integration – von Pilotprojekten über Schulungen bis zur Anpassung von Arbeitsabläufen.
Die erfolgreiche Umsetzung hängt von klaren Strategien, einer soliden Infrastruktur und der Akzeptanz durch das medizinische Personal ab. Einrichtungen, die diese Herausforderungen meistern, können die Vorteile der KI optimal nutzen.
Wo und Wie KI-Applikationen integrieren? - KI in der Medizin by Felix Nensa & MedMile
Voraussetzungen und Anforderungen für die Integration
Um den Einsatz von KI-Diagnostik erfolgreich in den klinischen Alltag zu integrieren, sind sorgfältige Vorbereitungen auf verschiedenen Ebenen notwendig. Ohne die richtigen technischen, rechtlichen und organisatorischen Grundlagen bleibt das Potenzial solcher Technologien ungenutzt.
Technische Infrastruktur-Anforderungen
Die technische Infrastruktur bildet das Rückgrat jeder KI-Integration im Gesundheitswesen. Ein zentraler Punkt ist die Dateninteroperabilität: KI-Systeme müssen problemlos mit bestehenden Krankenhausinformationssystemen (KIS) und Praxisverwaltungssystemen kommunizieren können. Standards wie HL7 FHIR oder DICOM sollten daher bereits implementiert sein.
Auch die IT-Infrastruktur muss leistungsfähig genug sein. KI-Anwendungen, insbesondere in der Bildanalyse, benötigen hohe Rechenkapazitäten. Viele Einrichtungen setzen auf Cloud-basierte Lösungen, die flexibel skalierbar sind. Dabei sind jedoch die strengen Datenschutzvorgaben des deutschen Gesundheitswesens zu beachten.
Ein weiterer wichtiger Aspekt ist die Cybersicherheit. Regelmäßige Sicherheitsupdates, verschlüsselte Datenübertragungen und sichere Authentifizierungsverfahren sind unverzichtbar. Zudem müssen Backup- und Wiederherstellungsstrategien so gestaltet sein, dass sie den Anforderungen des Gesundheitswesens gerecht werden – denn Ausfälle können in kritischen Situationen gravierende Folgen haben.
Die Netzwerkinfrastruktur sollte ebenfalls für die Übertragung großer Datenmengen optimiert sein. Radiologische Bilder und andere medizinische Daten können mehrere Gigabyte umfassen. Eine unzureichende Bandbreite würde die Effizienz der KI-Anwendungen erheblich beeinträchtigen.
Sobald die technische Grundlage geschaffen ist, rücken rechtliche Rahmenbedingungen und die Schulung des Personals in den Fokus.
Regulatorische und rechtliche Compliance
Die Einhaltung gesetzlicher Vorgaben ist ein Muss. Wie bereits im Regulierungsüberblick erwähnt, sind umfassende Dokumentationen, Risikobewertungen und klinische Validierungen erforderlich.
Die Datenschutz-Grundverordnung (DSGVO) und das Bundesdatenschutzgesetz setzen klare Grenzen für den Umgang mit Gesundheitsdaten. Patientendaten sollten, wo immer möglich, pseudonymisiert oder anonymisiert verarbeitet werden. Die Zustimmung der Patienten muss transparent und verständlich eingeholt werden.
Die Risikoklassifizierung der KI-Systeme spielt eine entscheidende Rolle: Hochrisiko-Anwendungen unterliegen strengeren Vorgaben. Eine gründliche Risikobewertung zu Beginn des Projekts hilft, die notwendigen Maßnahmen zu identifizieren.
Auch die Dokumentationspflichten sind umfangreich. Dazu gehören technische Dokumentationen, Protokolle über Systementscheidungen, Trainingsverfahren und Leistungsmetriken. Diese Unterlagen müssen jederzeit für Prüfungen durch Behörden oder Auditoren verfügbar sein.
Nicht zuletzt ist die Haftungsfrage zu klären. Klare Vereinbarungen zwischen Ärzten und KI-Anbietern sind notwendig, wobei die rechtliche Verantwortung für medizinische Entscheidungen weiterhin beim behandelnden Arzt liegt.
Personalschulung und Change Management
Der Erfolg einer KI-Integration hängt maßgeblich vom Menschen ab. Die digitalen Kompetenzen des medizinischen Personals müssen gezielt gefördert werden, da die Vorkenntnisse im Umgang mit digitalen Technologien oft stark variieren.
Schulungsprogramme sollten sowohl die technischen als auch die medizinischen Grundlagen der KI-Systeme abdecken. Es ist wichtig, dass das Personal versteht, wie die KI zu ihren Empfehlungen kommt, um diese kritisch hinterfragen zu können. Praktische Übungen mit realen Fallbeispielen haben sich dabei als besonders hilfreich erwiesen.
Da Widerstand gegen Veränderungen oft ein Hindernis darstellt, ist es wichtig, diesen aktiv anzugehen. Transparente Kommunikation über die Vorteile der KI und die Einbindung von Meinungsführern im Team können die Akzeptanz fördern. Die Botschaft sollte dabei klar sein: KI unterstützt das Personal, ersetzt es aber nicht.
Kontinuierliche Weiterbildung ist essenziell, da KI-Systeme durch Updates und neue Trainingszyklen ständig weiterentwickelt werden. Regelmäßige Auffrischungskurse und ein internes Expertennetzwerk helfen, das Wissen aktuell zu halten.
Auch die Arbeitsabläufe müssen an die neuen Technologien angepasst werden. Dies kann eine Umgestaltung etablierter Prozesse erfordern, die kurzfristig zu Effizienzverlusten führen kann. Eine schrittweise Einführung mit ausreichenden Übergangszeiten minimiert solche Störungen.
Schließlich sind Feedback-Mechanismen zwischen dem Personal und der IT-Abteilung entscheidend. Regelmäßige Rückmeldungen und Anpassungen auf Basis der Erfahrungen der Anwender sorgen dafür, dass die KI-Systeme optimal in den klinischen Alltag integriert werden.
Schritt-für-Schritt-Implementierungsleitfaden
Die Einführung von KI-Diagnostik erfordert einen gut durchdachten, sicheren und strukturierten Ansatz. Mit einer klaren Strategie lassen sich Risiken minimieren und der Nutzen maximieren. Der erste Schritt besteht darin, die spezifischen Anforderungen und Einsatzmöglichkeiten zu ermitteln.
Bewertung des klinischen Bedarfs
Um KI sinnvoll einzusetzen, müssen konkrete Anwendungsbereiche identifiziert werden, in denen sie einen echten Mehrwert bietet. Nicht jede medizinische Disziplin eignet sich gleichermaßen für KI. Die Radiologie ist ein gutes Beispiel, da hier digitale Bilddaten und standardisierte Bewertungsmethoden bereits etabliert sind.
Eine systematische Bedarfsanalyse sollte sich auf folgende Fragen konzentrieren: Welche diagnostischen Prozesse sind besonders zeitaufwendig oder fehleranfällig? Wo fehlt es an Fachpersonal? In welchen Bereichen könnten KI-basierte Zweitmeinungen die Diagnosequalität verbessern? Solche Überlegungen helfen, die Bereiche mit dem größten Potenzial zu identifizieren.
Ein weiterer wichtiger Faktor ist die Verfügbarkeit hochwertiger, strukturierter Daten. Bereiche mit gut dokumentierten und digitalisierten Informationen bieten eine solide Grundlage für den Einsatz von KI.
Die Erfolgsmessung sollte von Anfang an eingeplant werden. Klare Kennzahlen wie Diagnosegeschwindigkeit, Genauigkeit oder Zufriedenheit der Patienten ermöglichen später eine objektive Bewertung des Nutzens.
Auswahl von Tools und Anbietern
Die Wahl des richtigen KI-Systems und Anbieters ist entscheidend für den Projekterfolg. In Deutschland ist eine CE-Kennzeichnung und eine Zulassung als Medizinprodukt zwingend erforderlich. Systeme ohne diese Zertifizierungen dürfen nicht in der klinischen Praxis eingesetzt werden.
Technische Aspekte wie Kompatibilität und Datenschutz spielen eine zentrale Rolle. Das KI-System muss problemlos mit Krankenhausinformationssystemen, PACS und anderen Anwendungen zusammenarbeiten. Proprietäre Schnittstellen, die zu Abhängigkeiten von einzelnen Anbietern führen, sollten vermieden werden.
Die Einhaltung der DSGVO ist unerlässlich. Anbieter müssen nachweisen, dass sie die strengen Anforderungen an den Schutz von Gesundheitsdaten erfüllen. Diese Vorgaben sollten vertraglich klar geregelt sein.
Wissenschaftlich fundierte Validierungen sind ein Muss. Anbieter sollten peer-reviewte Studien vorlegen, die die Leistungsfähigkeit ihrer Algorithmen belegen. Besonders wichtig sind Validierungsstudien mit Patientendaten aus Deutschland oder Europa, da sich demografische Unterschiede auf die Ergebnisse auswirken können.
Auch die Kostenstruktur sollte transparent sein. Eine gründliche Total-Cost-of-Ownership-Analyse hilft, die langfristigen finanziellen Auswirkungen abzuschätzen.
Pilotierung und Validierung
Bevor ein KI-System flächendeckend eingeführt wird, sollte es in einem kontrollierten Pilotprojekt getestet werden. Dieser Ansatz minimiert Risiken und erlaubt es, wertvolle Erfahrungen zu sammeln. Die Pilotphase sollte in einem überschaubaren Bereich mit engagierten Mitarbeitenden durchgeführt werden, die später als Multiplikatoren dienen können.
Während der Pilotphase sollten die Ergebnisse des KI-Systems mit etablierten Diagnoseverfahren verglichen werden. Dieser parallele Ansatz ermöglicht eine objektive Bewertung der Systemleistung und schafft Vertrauen bei den Nutzern.
Feedback ist in dieser Phase entscheidend. Regelmäßige Umfragen, Workshops und Gespräche helfen, Schwachstellen zu identifizieren und Verbesserungen vorzunehmen. Besonders wichtig sind Rückmeldungen zur Benutzerfreundlichkeit, Zeitersparnis und diagnostischen Qualität.
Eine gründliche Dokumentation der Erfahrungen während der Pilotphase ist unerlässlich. Sie dient nicht nur der internen Qualitätssicherung, sondern auch als Nachweis gegenüber Regulierungsbehörden. Zudem können erfolgreiche Ansätze übernommen und Fehler vermieden werden.
Die Arbeitsabläufe sollten schrittweise angepasst werden. Die Integration eines KI-Systems erfordert oft Veränderungen bestehender Prozesse, die in der Pilotphase getestet und optimiert werden können.
Workflow-Integration und Schulung
Für eine erfolgreiche Einführung müssen KI-Systeme nahtlos in bestehende Arbeitsabläufe integriert werden. Sie sollten den klinischen Alltag erleichtern, nicht verkomplizieren. Oft sind Anpassungen an etablierten Prozessen notwendig, um die neuen Möglichkeiten optimal zu nutzen.
Schulungen spielen eine zentrale Rolle. Sie sollten auf die Bedürfnisse der verschiedenen Berufsgruppen zugeschnitten sein und praxisnah gestaltet werden. Hands-on-Training mit realen Fällen hat sich als besonders effektiv erwiesen. Es reicht nicht aus, die Systeme theoretisch zu erklären – das Personal muss die Möglichkeit haben, sie in einer sicheren Umgebung auszuprobieren und praktische Erfahrungen zu sammeln.
sbb-itb-49a712f
Häufige Herausforderungen und praktische Lösungen
Die Integration von KI-Diagnostik in den klinischen Alltag bringt eine Vielzahl von Herausforderungen mit sich. Neben den technischen und organisatorischen Grundlagen treten im praktischen Einsatz zusätzliche Hürden auf.
Datenqualität und Interoperabilität
Ein großes Problem im deutschen Gesundheitssystem ist der Umgang mit fragmentierten und unstrukturierten Gesundheitsdaten. Die isolierten Datensilos erschweren die Nutzung von KI-Anwendungen erheblich, da sie den Zugang zu qualitativ hochwertigen Trainingsdaten und die praktische Umsetzung behindern [1].
Ein positives Beispiel liefert die Universitätsmedizin Essen (UME). Mit ihrer FHIR-Plattform konnten bis Anfang 2025 über 1,6 Billionen Ressourcen integriert und mehr als 1,5 Millionen Patienten verwaltet werden. Beeindruckend ist auch das tägliche Wachstum: Rund 600.000 neue Ressourcen werden jeden Tag hinzugefügt [1].
Praktische Ansätze zur Lösung dieses Problems umfassen die Einführung von FHIR-Standards, gezielte Investitionen in die Datenbereinigung sowie die Strukturierung vorhandener Informationen. Neben den technischen Aspekten rücken jedoch auch ethische und rechtliche Fragen immer stärker in den Fokus.
Ethische und rechtliche Herausforderungen
Ein zentraler Punkt ist die transparente Kommunikation mit den Patienten. Sie müssen genau darüber informiert werden, wie ihre Daten verwendet werden und welche Rolle KI im Diagnoseprozess spielt. Trotz der Unterstützung durch KI bleibt die Verantwortung für die Diagnose letztlich beim behandelnden Arzt. Um die Entscheidungswege nachvollziehbar zu machen, ist eine lückenlose Dokumentation essenziell.
Akzeptanz der Mitarbeiter und digitale Kompetenzen
Die Einführung von KI-Technologien kann bei Mitarbeitern Unsicherheiten auslösen – sei es die Angst vor Arbeitsplatzverlust oder das Gefühl, mit den technologischen Anforderungen nicht Schritt halten zu können. Deshalb sind offene Kommunikation und die frühzeitige Einbindung der Belegschaft entscheidend.
Da die digitalen Kompetenzen innerhalb eines Teams oft stark variieren, ist ein differenzierter Ansatz notwendig. Jüngere Mitarbeiter sind häufig technikaffiner, während erfahrenere Fachkräfte intensivere Unterstützung benötigen. Generationsübergreifende Schulungen und der Einbezug von Meinungsführern aus verschiedenen Abteilungen können die Akzeptanz fördern. Regelmäßige Feedback-Runden und das Feiern kleiner Erfolge tragen dazu bei, die Motivation aufrechtzuerhalten.
Kosten und ROI-Berechnung
Die Einführung von KI ist mit erheblichen Investitionen verbunden. Dazu gehören Kosten für Software, Hardware-Upgrades, Schulungen und Wartung. Eine realistische Kalkulation der Kosten ist daher unverzichtbar.
Laut einer Umfrage glauben 64 % der deutschen Gesundheitsentscheider, dass KI das Gesundheitssystem grundlegend verändern wird [3]. Dennoch haben bisher nur 30 % der Gesundheits-CEOs KI-Lösungen eingeführt [3]. Das Potenzial ist jedoch enorm: Es wird geschätzt, dass die Gesundheitsausgaben in Europa in den nächsten zehn Jahren um einen dreistelligen Milliardenbetrag gesenkt werden könnten [3].
Für eine fundierte ROI-Berechnung sollte der Fokus auf kostenintensiven Krankheitsbereichen liegen. Hier können präzisere Diagnosen, frühzeitige Erkennung und personalisierte Behandlungspläne erhebliche Einsparungen ermöglichen. Auch die Automatisierung von Routineaufgaben kann die Produktivität steigern und sollte in die Kalkulation einfließen. Erfahrungen aus der Schweiz, etwa mit arztbasierten Call-Centern wie Medgate, Medi24 oder Sante24, zeigen, dass durch solche Ansätze sowohl die Überweisungsqualität verbessert als auch Kosten gesenkt werden konnten – und das über einen Zeitraum von rund zehn Jahren [2].
Ethische, rechtliche und regulatorische Überlegungen
Die Einführung von KI-Diagnostik bringt eine Vielzahl an ethischen, rechtlichen und regulatorischen Fragen mit sich, die sorgfältig adressiert werden müssen. Nach der Betrachtung technischer und organisatorischer Aspekte folgt hier ein genauerer Blick auf diese wichtigen Themen.
Ethische Herausforderungen in der KI-Diagnostik
Transparenz und Nachvollziehbarkeit sind zentrale ethische Anforderungen. Patienten haben ein Recht darauf zu wissen, wann und wie KI-Systeme bei ihrer Diagnose zum Einsatz kommen. Doch die oft undurchsichtige "Black Box"-Natur vieler Algorithmen macht es schwierig, die Entscheidungswege vollständig offenzulegen.
Die informierte Einwilligung muss an die Nutzung von KI angepasst werden. Patienten sollten genau verstehen, welche Daten für die Analyse verwendet werden und welche Auswirkungen dies auf ihre Behandlung haben könnte.
Fairness und die Vermeidung von Bias sind ebenfalls entscheidend. KI-Systeme können Vorurteile aus den Trainingsdaten übernehmen, was dazu führen kann, dass bestimmte Patientengruppen benachteiligt werden – insbesondere solche, die in den Datensätzen unterrepräsentiert sind.
Darüber hinaus ist die Wahrung der Entscheidungsfreiheit der Patienten unerlässlich. Jeder Patient sollte die Möglichkeit haben, einer KI-gestützten Diagnose zu widersprechen und eine rein menschliche Beurteilung zu verlangen.
Deutsche Regulierungskonformität
Neben ethischen Überlegungen müssen auch die regulatorischen Anforderungen eingehalten werden. In Deutschland spielen dabei verschiedene gesetzliche Rahmenwerke eine Rolle:
- Die Medizinprodukteverordnung (MDR) legt je nach Risikokategorie der KI-Systeme unterschiedliche Anforderungen fest. Systeme mit höherem Risiko unterliegen strengeren Auflagen, etwa hinsichtlich klinischer Studien und Dokumentation.
- Die EU-KI-Verordnung (AI Act), die schrittweise ab 2024 umgesetzt wird, stellt zusätzliche Anforderungen an Hochrisiko-KI-Systeme im Gesundheitswesen. Dazu gehören Vorgaben zu Risikomanagement, Datenqualität, Transparenz und menschlicher Kontrolle.
- Die DSGVO verlangt eine rechtmäßige, zweckgebundene und sparsame Verarbeitung von Daten. Besonders für das Training von KI-Systemen mit Gesundheitsdaten ist eine spezifische Rechtsgrundlage erforderlich.
- Das Sozialgesetzbuch V (SGB V) regelt, welche KI-basierten Leistungen von Krankenkassen erstattet werden. Der Gemeinsame Bundesausschuss (G-BA) bewertet dabei den Nutzen und die Wirtschaftlichkeit neuer Technologien.
Haftung bei KI-unterstützten Entscheidungen
Die Frage der Haftung ist ein weiterer zentraler Punkt, der über die regulatorischen Anforderungen hinausgeht und spezifische interne Regelungen erforderlich macht.
- Verantwortung: Der behandelnde Arzt bleibt rechtlich verantwortlich und muss die Empfehlungen der KI kritisch hinterfragen. Eine automatische Übernahme der Ergebnisse ist nicht zulässig.
- Dokumentationspflichten: Der Einsatz von KI erweitert die Anforderungen an die Dokumentation. Ärzte müssen nachvollziehbar festhalten, welche KI-Systeme genutzt wurden, welche Ergebnisse diese lieferten und wie diese in die Diagnose eingeflossen sind.
- Produkthaftung: Hersteller von KI-Systemen müssen ihre Entwicklungsprozesse, Tests und Validierungen umfassend dokumentieren. Bei Fehldiagnosen können sowohl Ärzte als auch Hersteller haftbar gemacht werden.
- Versicherungsschutz: Krankenhäuser und Praxen sollten sicherstellen, dass ihre Berufshaftpflichtversicherung auch Schäden abdeckt, die durch KI-gestützte Behandlungen entstehen.
Vergleichstabelle: Regulatorische Anforderungen nach Risikokategorie
| Risikokategorie | Beispiele | MDR-Klasse | Klinische Studien | Benannte Stelle | CE-Kennzeichnung | KI-VO Anforderungen |
|---|---|---|---|---|---|---|
| Niedriges Risiko | Wellness-Apps, einfache Datenauswertung | Klasse I | Nicht erforderlich | Nein | Selbstzertifizierung | Grundlegende Transparenz |
| Mittleres Risiko | Bildanalyse für Screening | Klasse IIa | Begrenzte klinische Daten | Ja | Erforderlich | Risikomanagement, Datenqualität |
| Hohes Risiko | Diagnostische Bildgebung, Therapieempfehlungen | Klasse IIb | Umfangreiche klinische Studien | Ja | Erforderlich | Vollständige Konformitätsbewertung |
| Sehr hohes Risiko | Lebenserhaltende Systeme, chirurgische Robotik | Klasse III | Randomisierte kontrollierte Studien | Ja | Erforderlich | Höchste Sicherheitsanforderungen |
Die Umsetzung dieser Anforderungen erfordert eine enge Zusammenarbeit zwischen Klinikleitung, IT-Abteilung, Rechtsberatern und Ärzten. Regelmäßige Schulungen und klar definierte interne Leitlinien sind dabei essenziell, um sowohl die gesetzlichen Vorgaben zu erfüllen als auch die Vorteile der KI-Diagnostik sicher und effektiv zu nutzen.
Fazit
Die Einführung von KI-Diagnostik im Gesundheitswesen ist ein komplexer und schrittweiser Prozess, der sorgfältige Planung, technisches Know-how und organisatorische Anpassungen erfordert. Der Erfolg hängt davon ab, wie gut Krankenhäuser und Praxen technische Infrastruktur, rechtliche Anforderungen und ethische Überlegungen miteinander in Einklang bringen. Hier sind einige der wichtigsten Aspekte zusammengefasst:
Zentrale Erkenntnisse
Strukturierte Umsetzung und regelmäßige Überprüfung sind unverzichtbar. Eine schrittweise Einführung, angefangen bei einer detaillierten Bedarfsanalyse über Pilotprojekte bis hin zur vollständigen Integration, hilft Risiken zu minimieren und die Erfolgschancen zu erhöhen. Durch kontinuierliche Evaluation können Arbeitsabläufe angepasst und optimiert werden, um den Nutzen weiter zu steigern.
Schulungen und klare Compliance-Regeln fördern Akzeptanz und vermeiden rechtliche Probleme. Regelmäßige Weiterbildung und praxisorientierte Trainings vermitteln nicht nur das nötige Wissen, sondern helfen auch, Berührungsängste abzubauen. Die Einhaltung von Vorschriften wie der MDR, der EU-KI-Verordnung und der DSGVO erfordert eine enge Zusammenarbeit zwischen IT-Experten, Juristen und der Klinikleitung.
Qualitativ hochwertige und strukturierte Daten sind unerlässlich. Investitionen in die Bereinigung, Standardisierung und Interoperabilität von Daten sind oft entscheidender für den Projekterfolg als die Wahl des eigentlichen KI-Systems. Diese Grundlagen sichern langfristig die Effizienz und Genauigkeit der Diagnostik.
Zukunft der KI im deutschen Gesundheitswesen
Mit diesen Grundlagen wird KI zweifellos eine zentrale Rolle in der Zukunft der deutschen Medizin spielen. Deutschland befindet sich an einem entscheidenden Punkt in der Digitalisierung des Gesundheitswesens. Die schrittweise Umsetzung der EU-KI-Verordnung ab 2024 bietet einen rechtlichen Rahmen, der Innovationen fördert und gleichzeitig die Patientensicherheit gewährleistet. Parallel dazu stärken Initiativen wie die Telematikinfrastruktur und das Elektronische Patientendossier die Interoperabilität – ein Schlüsselfaktor für den erfolgreichen Einsatz von KI.
Die kommenden Jahre werden zeigen, welche Einrichtungen die Integration von KI erfolgreich meistern. Dabei wird weniger die Geschwindigkeit der Einführung entscheidend sein, sondern vielmehr die Qualität der Umsetzung. Investitionen in Infrastruktur, Schulungen und Prozessverbesserungen sind der Schlüssel zu einer Medizin, die präziser, effizienter und stärker auf die Bedürfnisse der Patienten ausgerichtet ist.
Dr. Sven Jungmann begleitet Organisationen mit Vorträgen und Beratungen, um KI-Projekte im Gesundheitswesen optimal umzusetzen. Mit seiner Erfahrung in digitaler Gesundheit und Innovationsmanagement unterstützt er Einrichtungen dabei, die digitale Transformation erfolgreich zu gestalten und das Potenzial der KI-Diagnostik voll auszuschöpfen.
Die Integration von KI-Diagnostik ist weit mehr als ein technisches Update – sie ist ein Schritt hin zu einer Medizin, die nicht nur effizienter, sondern auch menschlicher wird. Denn sie schenkt Ärzten mehr Zeit für das, was wirklich zählt: die Behandlung ihrer Patienten.
FAQs
Welche technischen und organisatorischen Voraussetzungen sind notwendig, um KI-Diagnostik erfolgreich in den Klinikalltag zu integrieren?
Um künstliche Intelligenz (KI) erfolgreich in den Klinikalltag einzubinden, brauchen Krankenhäuser flexible und sichere Dateninfrastrukturen, die den Austausch von Patientendaten ermöglichen. Wichtig ist, dass diese Systeme auf offenen Standards beruhen, damit unterschiedliche Technologien miteinander kompatibel sind und reibungslos zusammenarbeiten können.
Ebenso essenziell ist die Einführung von ethischen Richtlinien und klaren Abläufen, um den verantwortungsvollen Einsatz von KI sicherzustellen. Dazu gehört der Schutz von sensiblen Patientendaten, die Minimierung von Verzerrungen (Bias) in den Algorithmen und die gezielte Schulung des medizinischen Personals im Umgang mit KI-Systemen. Eine enge Zusammenarbeit zwischen IT-Experten, medizinischem Fachpersonal und der Klinikleitung spielt dabei eine Schlüsselrolle.
Wie können medizinische Einrichtungen sicherstellen, dass KI-Diagnosesysteme den Datenschutz- und Sicherheitsanforderungen entsprechen?
Um sicherzustellen, dass KI-Diagnosesysteme den Anforderungen an Datenschutz und Sicherheit gerecht werden, sollten medizinische Einrichtungen einige wesentliche Schritte unternehmen. Dazu zählt vor allem der Aufbau sicherer und kompatibler Dateninfrastrukturen, die den Schutz sensibler Informationen gewährleisten. Ebenso entscheidend ist die strikte Einhaltung der Datenschutz-Grundverordnung (DSGVO) sowie regelmäßige Prüfungen, um mögliche Sicherheitslücken frühzeitig zu erkennen und zu beheben.
Ein weiterer wichtiger Aspekt ist die Entwicklung klarer ethischer Leitlinien für den Einsatz von KI. Dabei muss sichergestellt werden, dass die verwendeten Datensätze von hoher Qualität sind, anonymisiert vorliegen und keine Verzerrungen enthalten. Die seit dem 1. August 2024 gültige EU-KI-Verordnung legt zudem spezifische Anforderungen für sogenannte hochriskante KI-Systeme fest. Diese umfassen unter anderem Mechanismen zur Risikominimierung sowie transparente und verständliche Benutzerinformationen. Mit diesen Maßnahmen können Kliniken nicht nur die gesetzlichen Vorgaben erfüllen, sondern auch das Vertrauen von Patienten und Mitarbeitenden nachhaltig stärken.
Wie kann medizinisches Personal optimal auf den Einsatz von KI-Diagnostik vorbereitet und deren Akzeptanz gefördert werden?
Um medizinisches Personal auf die Nutzung von KI-Diagnostik vorzubereiten und deren Akzeptanz zu steigern, sind gezielte Strategien unverzichtbar. Schulungen und Fortbildungen sollten im Mittelpunkt stehen, um digitale Fähigkeiten zu stärken und ein fundiertes Verständnis für die Möglichkeiten und Grenzen von KI zu schaffen. Dies gibt den Fachkräften die nötige Sicherheit im Umgang mit neuen Technologien.
Vertrauen ist dabei ein Schlüsselfaktor: KI-Anwendungen müssen transparent sein, damit die zugrunde liegenden Daten und Entscheidungsprozesse nachvollziehbar bleiben. Ebenso wichtig ist die reibungslose Integration von KI-Systemen in bestehende Arbeitsabläufe, um den klinischen Alltag zu erleichtern, anstatt zusätzliche Hürden zu schaffen.
Auch die Kommunikation mit Patient:innen spielt eine entscheidende Rolle. Ein offener Dialog über den Einsatz von KI kann Bedenken abbauen und das Vertrauen sowohl bei den Behandelnden als auch bei den Patient:innen stärken. So kann KI zu einem wertvollen Hilfsmittel im Gesundheitswesen werden.
Verwandte Blogbeiträge
- KI im Gesundheitswesen: 7 praktische Anwendungen
- KI-Implementierung: Häufige Fragen beantwortet
- KI-gestützte Dokumentation: 5 Vorteile für Ärzte
- Wie generative KI Ärzte bei Diagnosen unterstützt
Seltene Krankheiten: Wie maschinelles Lernen hilft
Die Diagnose seltener Krankheiten ist oft langwierig und belastend. In Deutschland sind etwa 4 Millionen Menschen von über 8.000 seltenen Krankheiten betroffen, doch die richtige Diagnose dauert im Schnitt 5 bis 7 Jahre. Maschinelles Lernen (ML) bietet neue Ansätze, um diesen Prozess zu beschleunigen und zu verbessern:
- Schnellere Diagnosen: Algorithmen analysieren riesige Datenmengen wie Genomdaten, medizinische Bilder oder klinische Texte effizienter als Menschen.
- Präzisere Ergebnisse: ML erkennt komplexe Muster und Symptomkombinationen, die oft übersehen werden.
- Unterstützung für Ärzte: Besonders in ländlichen Regionen kann ML Wissen von Experten zugänglich machen.
Trotz technischer Fortschritte gibt es Herausforderungen wie begrenzte Daten, Datenschutzfragen und die Notwendigkeit, ML-Modelle in den klinischen Alltag zu integrieren. Die Zukunft liegt in der Kombination aus Technologie und menschlicher Expertise, um Diagnosen zu verbessern und die Lebensqualität der Betroffenen zu steigern.
Operation Zukunft – Mit KI Krankheiten erkennen (Folge 1)
Wie maschinelles Lernen die Diagnose seltener Krankheiten verändert
Maschinelles Lernen verändert grundlegend, wie Ärztinnen und Ärzte seltene Krankheiten erkennen und behandeln. Diese Technologie kann riesige Datenmengen analysieren und dabei Muster aufdecken, die mit herkömmlichen Methoden oft übersehen werden. Während klassische Ansätze stark auf die Erfahrung einzelner Mediziner setzen, ermöglicht maschinelles Lernen die gleichzeitige Verarbeitung unzähliger Datenpunkte. Dadurch lassen sich Zusammenhänge erkennen, die dem menschlichen Auge verborgen bleiben.
Ein weiterer Vorteil ist die schnellere Diagnosestellung. Wo traditionelle Verfahren oft langwierige Prozesse erfordern, können Algorithmen des maschinellen Lernens in kürzerer Zeit wertvolle Hinweise liefern. Dabei werden unterschiedliche Datenquellen – wie Genomsequenzen, medizinische Bilder oder klinische Notizen – kombiniert, um ein präzises diagnostisches Gesamtbild zu erstellen.
Was ist maschinelles Lernen?
Maschinelles Lernen ist ein Teilgebiet der künstlichen Intelligenz, das es Computersystemen ermöglicht, eigenständig aus Daten zu lernen und Vorhersagen zu treffen, ohne dass sie dafür explizit programmiert werden müssen. Statt starrer Regeln entwickeln diese Systeme ihre Erkenntnisse durch die Analyse großer Datenmengen.
Die Technologie arbeitet mit sogenannten Trainingsdaten, beispielsweise anonymisierten Patientenakten, um Muster zu erkennen. Dabei kommen verschiedene Ansätze zum Einsatz:
- Überwachtes Lernen: Hierbei werden vorab klassifizierte Datensätze genutzt, um spezifische Muster zu identifizieren.
- Unüberwachtes Lernen: Diese Methode sucht eigenständig nach verborgenen Strukturen in den Daten.
- Deep Learning: Mit Hilfe mehrschichtiger neuronaler Netzwerke können besonders komplexe Muster analysiert werden.
Diese Ansätze bilden die Grundlage dafür, wie maschinelles Lernen neue Möglichkeiten für die Diagnose seltener Krankheiten schafft.
Warum maschinelles Lernen für seltene Krankheiten wichtig ist
Die Diagnose seltener Krankheiten stellt besondere Herausforderungen dar, was maschinelles Lernen zu einem wichtigen Werkzeug macht. Da es oft nur wenige dokumentierte Fälle gibt, stoßen traditionelle Verfahren an ihre Grenzen. Maschinelles Lernen hingegen kann sämtliche verfügbaren Daten – auch aus internationalen Quellen – zusammenführen und daraus lernen.
Ein weiterer Vorteil liegt in der Fähigkeit, ungewöhnliche und komplexe Symptomkombinationen zu analysieren. Algorithmen können subtile Verbindungen erkennen und so selbst atypische Krankheitsverläufe frühzeitig identifizieren.
Zusätzlich hilft maschinelles Lernen, regionale Unterschiede in der medizinischen Expertise zu überbrücken. Während Expertinnen und Experten häufig in spezialisierten Zentren arbeiten, können ML-gestützte Diagnosehilfen auch in ländlichen Gebieten eingesetzt werden. So profitieren Hausärztinnen und Hausärzte von weltweit gesammeltem Wissen.
Durch die Verknüpfung unterschiedlichster Datenquellen entsteht ein umfassenderes Bild, das die Diagnosestellung verbessert. Jeder neue Fall trägt dazu bei, die Modelle weiterzuentwickeln und die Genauigkeit zu erhöhen – ein entscheidender Vorteil bei der Behandlung seltener Krankheiten.
Im nächsten Abschnitt wird gezeigt, wie diese Ansätze konkret in der Praxis angewendet werden.
Hauptanwendungen von maschinellem Lernen bei der Diagnose seltener Krankheiten
Maschinelles Lernen spielt eine zentrale Rolle dabei, die Diagnose seltener Krankheiten schneller und präziser zu gestalten. Durch die Analyse verschiedener Datentypen können Technologien in kürzerer Zeit genauere Ergebnisse liefern. Die folgenden Anwendungen verdeutlichen, wie Maschinelles Lernen in unterschiedlichen Bereichen zusammenwirkt, um seltene Krankheiten zu erkennen.
Analyse genetischer Daten
Die Genomanalyse ist ein bedeutender Bereich, in dem Maschinelles Lernen eingesetzt wird. Dank moderner Sequenzierungstechnologien entstehen riesige Datenmengen, die manuell kaum zu bewältigen sind. Hier kommen Algorithmen ins Spiel: Sie durchsuchen genetische Informationen systematisch und identifizieren krankheitsrelevante Mutationen.
Dabei analysieren die Algorithmen Varianten im menschlichen Genom und vergleichen sie mit bekannten Krankheitsmustern. Besonders wertvoll ist die Fähigkeit, nicht nur einzelne Genveränderungen zu betrachten, sondern auch komplexe Wechselwirkungen zwischen verschiedenen genetischen Faktoren aufzudecken. Das ist entscheidend, da viele seltene Krankheiten durch das Zusammenspiel mehrerer genetischer Varianten ausgelöst werden.
Mit jeder neuen genetischen Sequenz verbessern sich die Modelle weiter. Diese Fortschritte ermöglichen es, Kandidatengene zu priorisieren, sodass Ärztinnen und Ärzte ihre Untersuchungen auf die wahrscheinlichsten Ursachen fokussieren können. Das spart Zeit und Ressourcen, während gleichzeitig die Diagnosesicherheit steigt.
Neben genetischen Daten liefert die medizinische Bildgebung ebenfalls entscheidende Hinweise.
Mustererkennung in der medizinischen Bildgebung
Medizinische Bildgebung – wie CT, MRT oder Röntgen – enthält oft subtile Anzeichen für seltene Krankheiten, die selbst erfahrene Radiologinnen und Radiologen übersehen könnten. Maschinelles Lernen ist besonders gut darin, solche schwer erkennbaren Muster zu entdecken.
Durch das Training mit Tausenden von Bildern lernen Algorithmen, charakteristische Merkmale verschiedener Krankheiten und feinste Abweichungen zu identifizieren, die für das menschliche Auge kaum sichtbar sind. Gerade bei seltenen Erkrankungen, für die oft nur wenige Referenzbilder existieren, ist diese Fähigkeit äußerst hilfreich.
Tiefe neuronale Netze analysieren Bilder in mehreren Schichten. Sie erfassen sowohl grobe Strukturen als auch feinste Details und erstellen so ein umfassendes Bild der Pathologie. Diese mehrschichtige Analyse liefert oft präzisere Ergebnisse als traditionelle Methoden.
Ein weiterer Vorteil ist die Standardisierung der Bildauswertung. Während menschliche Interpretationen subjektiv sein können, bieten ML-Algorithmen konsistente und reproduzierbare Ergebnisse – ein entscheidender Faktor, wenn es an umfangreicher diagnostischer Erfahrung fehlt.
Neben der Bildanalyse spielt auch die Auswertung von Textdaten eine immer größere Rolle.
Natural Language Processing in der klinischen Dokumentation
Klinische Texte wie Arztbriefe, Laborberichte oder wissenschaftliche Artikel enthalten wertvolle Informationen, die oft unstrukturiert vorliegen. Natural Language Processing (NLP) hilft dabei, diese Informationen für die Diagnose seltener Krankheiten nutzbar zu machen.
NLP-Algorithmen erkennen medizinische Fachbegriffe, Synonyme und Abkürzungen und analysieren Symptomkombinationen in Patientenakten – selbst wenn diese in unterschiedlichen Dokumenten oder zu verschiedenen Zeitpunkten aufgezeichnet wurden. Während einzelne Symptome oft unspezifisch sind, können bestimmte Kombinationen auf seltene Krankheiten hinweisen.
Darüber hinaus ermöglicht NLP die automatische Literaturrecherche. Algorithmen durchsuchen aktuelle Forschungsergebnisse und identifizieren relevante Studien zu seltenen Erkrankungen. Diese Informationen fließen direkt in den diagnostischen Prozess ein und stellen sicher, dass auch die neuesten Erkenntnisse berücksichtigt werden.
Ein weiterer Einsatzbereich ist die Analyse von Behandlungsverläufen. NLP kann aus klinischen Notizen Therapieerfolge oder -misserfolge extrahieren und so zusätzliche Hinweise auf die zugrunde liegende Krankheit liefern. Diese retrospektive Auswertung unterstützt nicht nur die Diagnose, sondern hilft auch dabei, alternative Erklärungen zu finden oder bestehende Diagnosen zu bestätigen.
Implementierung von maschinellem Lernen im Gesundheitswesen
Die Einführung von maschinellem Lernen (ML) in die klinische Praxis erfordert durchdachte und gut abgestimmte Prozesse – besonders bei seltenen Krankheiten. Dabei gliedert sich der Implementierungsprozess in drei aufeinanderfolgende Phasen, die jeweils spezifische Herausforderungen mit sich bringen.
Datensammlung und -aufbereitung
Ohne qualitativ hochwertige Daten ist maschinelles Lernen zum Scheitern verurteilt. Klinische Daten müssen nicht nur umfangreich und repräsentativ sein, sondern auch strenge Datenschutzvorgaben erfüllen. In Deutschland spielen die Datenschutz-Grundverordnung (DSGVO) und zusätzliche nationale Regelungen eine zentrale Rolle.
Zunächst gilt es, vorhandene Datenquellen zu identifizieren und zu bewerten. Dazu zählen elektronische Patientenakten, Laborergebnisse, Bildgebungsdaten und genetische Informationen. Gerade bei seltenen Krankheiten ist die Datenbasis oft begrenzt, weshalb eine gezielte Auswahl und sorgfältige Aufbereitung umso wichtiger ist.
Ein unverzichtbarer Schritt ist die Anonymisierung der Patientendaten. Mit Techniken wie Verschlüsselung und Differential Privacy wird die Privatsphäre geschützt, ohne die Datenqualität zu beeinträchtigen. Ebenso entscheidend ist die Datenharmonisierung, da unterschiedliche Abteilungen und Systeme oft eigene Formate und Standards verwenden. Um diese Hürden zu überwinden, helfen internationale Standards wie HL7 FHIR oder SNOMED CT, die eine einheitliche Verarbeitung der Daten ermöglichen.
Training und Validierung von ML-Modellen
Für das Training der Algorithmen sind annotierte Datensätze unerlässlich. Bei seltenen Krankheiten bedeutet das, dass Fachleute die vorhandenen Fälle präzise kategorisieren und mit den entsprechenden Diagnosen verknüpfen müssen. Diese annotierten Daten dienen als Grundlage, damit das Modell Muster erkennen kann.
Die Übertragbarkeit des Modells wird durch Cross-Validation getestet, doch ein weiterer entscheidender Schritt ist die klinische Validierung. Hierbei werden die Ergebnisse der Algorithmen mit bestehenden diagnostischen Verfahren verglichen und von erfahrenen Ärztinnen und Ärzten überprüft. Die Modelle müssen nicht nur mathematisch korrekt arbeiten, sondern auch praktisch umsetzbare Empfehlungen liefern, die im klinischen Alltag Bestand haben.
Ein weiterer Aspekt ist das kontinuierliche Lernen. ML-Modelle entwickeln sich mit jedem neuen Fall weiter, der in das System eingespeist wird. Allerdings erfordert dieser Prozess eine ständige Überwachung, um sicherzustellen, dass die Algorithmen nicht durch neue Datenmuster fehlgeleitet werden.
Nach Abschluss der Optimierung wird das Modell in die klinischen Arbeitsabläufe integriert.
Integration in klinische Arbeitsabläufe
Die letzte Phase besteht darin, die validierte Technologie in den klinischen Alltag zu überführen. Der Erfolg hängt maßgeblich davon ab, wie gut ML-Tools in die täglichen Arbeitsprozesse von Ärztinnen und Ärzten integriert werden. Hierbei sind benutzerfreundliche Schnittstellen entscheidend.
Die ML-Systeme sollten als Entscheidungsunterstützung dienen, nicht als Ersatz für die medizinische Expertise. Die Algorithmen stellen ihre Ergebnisse in Form von Wahrscheinlichkeiten und Empfehlungen bereit, während die finale Diagnose und Behandlungsentscheidung weiterhin bei den behandelnden Ärztinnen und Ärzten liegt.
Eine reibungslose Workflow-Integration ist ebenfalls wichtig. Die ML-Tools müssen nahtlos mit bestehenden Krankenhausinformationssystemen zusammenarbeiten. Umständliche Datenimporte oder doppelte Eingaben können die Effizienz erheblich beeinträchtigen. API-basierte Lösungen bieten hier eine Möglichkeit, verschiedene Systeme miteinander zu verbinden.
Ein oft unterschätzter Punkt ist die Schulung des medizinischen Personals. Ärztinnen und Ärzte müssen verstehen, wie die Algorithmen arbeiten, welche Stärken sie haben und wo ihre Grenzen liegen. Nur so können sie die Ergebnisse korrekt interpretieren und in ihre Entscheidungen einfließen lassen.
Abschließend spielen Feedback-Mechanismen eine zentrale Rolle. Das System sollte dokumentieren, welche Empfehlungen umgesetzt wurden und wie sich die Behandlungsergebnisse entwickelt haben. Diese Rückmeldungen fließen in die Modellverbesserung ein und sorgen für eine stetige Weiterentwicklung der Algorithmen.
sbb-itb-49a712f
Vorteile und Grenzen von maschinellem Lernen bei seltenen Krankheiten
Maschinelles Lernen (ML) bringt sowohl Chancen als auch Herausforderungen für die Diagnostik seltener Krankheiten mit sich. Dabei ist es wichtig, die Möglichkeiten und Grenzen dieser Technologie im klinischen Alltag realistisch zu bewerten.
Vorteile von maschinellem Lernen
Maschinelles Lernen kann die Diagnosezeiten erheblich verkürzen. Patienten mit seltenen Krankheiten verbringen oft Jahre auf der Suche nach einer genauen Diagnose. ML-Algorithmen sind in der Lage, relevante Muster in Daten schneller zu erkennen, was eine schnellere Versorgung ermöglicht – ein entscheidender Vorteil, der in manchen Fällen sogar lebensrettend sein kann.
Ein weiterer Pluspunkt ist die gesteigerte diagnostische Genauigkeit. Algorithmen können große Datenmengen analysieren und dabei auch komplexe Symptomkombinationen und subtile Zusammenhänge identifizieren, die von Menschen möglicherweise übersehen werden. Besonders bei genetischen Erkrankungen bietet ML die Möglichkeit, genomische Varianten mit spezifischen phänotypischen Merkmalen in Verbindung zu bringen.
Darüber hinaus priorisiert ML vorhandene Daten, um potenzielle Diagnosen vorzuschlagen. Dies hilft Ärztinnen und Ärzten, auch seltene Krankheiten in Betracht zu ziehen, die sonst möglicherweise nicht direkt ins Auge gefasst würden.
Ein weiterer Vorteil ist die Skalierbarkeit von ML-Systemen. Sie ermöglichen es, spezialisiertes Wissen auch in Regionen verfügbar zu machen, in denen es an Experten mangelt.
Trotz dieser vielversprechenden Aspekte bringt die Technologie jedoch auch Herausforderungen und ethische Fragen mit sich, die nicht ignoriert werden dürfen.
Einschränkungen und ethische Überlegungen
Eine der größten Hürden bei seltenen Krankheiten ist die begrenzte Verfügbarkeit von Trainingsdaten. Ohne ausreichend Daten fehlt es den Modellen an Aussagekraft, was die Zuverlässigkeit der Ergebnisse beeinträchtigen kann.
Ein weiteres Problem sind Verzerrungen in den Trainingsdaten. Wenn bestimmte Bevölkerungsgruppen, Altersklassen oder Regionen unterrepräsentiert sind, können die Modelle für diese Gruppen ungenaue oder weniger zuverlässige Ergebnisse liefern. Dies birgt das Risiko, bestehende Ungleichheiten im Gesundheitssystem zu verschärfen.
Die mangelnde Transparenz vieler ML-Modelle stellt ebenfalls eine Herausforderung dar. Wenn ein Algorithmus eine Diagnose vorschlägt, ohne nachvollziehbar zu machen, wie er zu diesem Ergebnis gelangt ist, fällt es medizinischem Personal schwer, darauf zu vertrauen.
Auch rechtliche und ethische Fragen wie Datenschutz, Einwilligung und Verantwortlichkeiten sind oft unklar. Darüber hinaus können die hohen Kosten für die Implementierung – einschließlich Software, Schulungen und Wartung – kleinere Kliniken und Praxen davon abhalten, die Technologie zu nutzen.
Vergleichstabelle: Vor- und Nachteile
| Vorteile | Nachteile |
|---|---|
| Schnellere Diagnosen | Begrenzte Verfügbarkeit von Trainingsdaten |
| Höhere Genauigkeit bei komplexen Diagnosen | Verzerrte Daten können Ungleichheiten verstärken |
| Unterstützung bei seltenen Differentialdiagnosen | Mangelnde Transparenz der Entscheidungsfindung |
| Zugang zu Expertenwissen in entlegenen Regionen | Unklare rechtliche Verantwortlichkeiten |
| Langfristig potenzielle Kosteneinsparungen | Hohe Anfangsinvestitionen und laufende Kosten |
| Kontinuierliche Verbesserung durch neue Daten | Abhängigkeit von technischer Infrastruktur |
| Erkennung subtiler Muster in großen Datenmengen | Datenschutzprobleme bei sensiblen Informationen |
In der Praxis zeigt sich, dass maschinelles Lernen am effektivsten als unterstützendes Werkzeug genutzt wird. Es hilft Ärztinnen und Ärzten, präzisere Diagnosen zu stellen, während die finale Entscheidung und Verantwortung weiterhin in ihren Händen liegt. Die Technologie ergänzt die menschliche Expertise, ohne sie zu ersetzen.
Zukunftsperspektiven und Expertenberatung
Maschinelles Lernen in der Medizin steckt noch in den Kinderschuhen, doch die Entwicklungen sind vielversprechend. Neue Technologien und Forschungsansätze könnten die Diagnostik seltener Krankheiten in naher Zukunft grundlegend verändern. Gleichzeitig wird die Rolle von Experten immer wichtiger, um diese komplexen Technologien erfolgreich in die Praxis zu integrieren.
Neue Technologien und Forschungsansätze
Deep Phenotyping revolutioniert die Art und Weise, wie seltene Krankheiten analysiert werden. Durch die Kombination detaillierter phänotypischer und genomischer Daten können Algorithmen Zusammenhänge erkennen, die bisher unentdeckt blieben. Dies ermöglicht eine präzisere Identifikation von genetischen Variationen und deren klinischen Auswirkungen.
Federated Learning bietet eine innovative Lösung für die Nutzung sensibler Daten. Krankenhäuser und Forschungseinrichtungen können ihre Daten verwenden, ohne sie physisch zu teilen. Dies ist besonders bei seltenen Krankheiten hilfreich, da so größere Datenmengen für das Training von Modellen genutzt werden können, ohne Datenschutzrisiken einzugehen.
Multimodale KI-Systeme gehen einen Schritt weiter, indem sie verschiedene Datenquellen wie Genomdaten, medizinische Bildgebung und klinische Notizen kombinieren. Diese umfassende Betrachtung liefert ein vollständigeres Bild des Patienten und führt zu präziseren Diagnosen.
Erklärbare KI bringt Transparenz in die Entscheidungsfindung von Algorithmen. Ärzte und Patienten können nachvollziehen, wie eine Diagnose zustande kam, was das Vertrauen in diese Systeme stärkt.
Synthetische Daten sind eine weitere Möglichkeit, das Problem begrenzter Datensätze zu lösen. Mit ihrer Hilfe lassen sich künstliche, aber realistische Patientendaten generieren, die für das Training von Modellen genutzt werden können, ohne die Privatsphäre echter Patienten zu gefährden.
Trotz dieser technologischen Fortschritte bleibt die Expertise von Fachleuten entscheidend, um diese Innovationen erfolgreich in den klinischen Alltag zu integrieren.
Der Wert von Expertenberatung
Die Implementierung von maschinellem Lernen im Gesundheitswesen erfordert mehr als technisches Wissen. Es braucht ein tiefes Verständnis der Möglichkeiten und Grenzen dieser Technologien, um sie effektiv einzusetzen. Genau hier wird die Unterstützung durch Experten unverzichtbar.
Dr. Sven Jungmann ist ein gefragter Experte in den Bereichen künstliche Intelligenz, digitale Gesundheit und Innovation. Mit seinen Vorträgen und Schulungen hilft er Organisationen, die digitale Transformation zu meistern und KI-Lösungen erfolgreich einzuführen. Seine praxisnahen Einblicke in technologische Entwicklungen sind besonders wertvoll für Führungskräfte und medizinisches Personal.
Die Komplexität moderner KI-Systeme stellt Entscheidungsträger oft vor Herausforderungen. Expertenberatung hilft, realistische Erwartungen zu setzen und Prioritäten richtig zu definieren. Gerade bei seltenen Krankheiten, wo die Lösungen oft komplex sind, ist diese Unterstützung entscheidend.
Auch Schulungen für medizinisches Personal spielen eine zentrale Rolle. Ärzte müssen verstehen, wie KI-Systeme arbeiten, um sie verantwortungsvoll nutzen zu können. Sie lernen, wann sie den Algorithmen vertrauen können und wann ein kritisches Hinterfragen notwendig ist.
Die Innovationsberatung unterstützt Gesundheitseinrichtungen dabei, KI-Projekte von der Planung bis zur Umsetzung zu begleiten. Dazu gehört die Auswahl passender Technologien, die Entwicklung von Strategien und die Bewältigung regulatorischer Anforderungen.
Start-ups und Investmentfirmen im Bereich Digital Health profitieren ebenfalls von spezialisierter Beratung. Fachwissen in KI, Big Data und digitalen Plattformen hilft dabei, vielversprechende Technologien zu erkennen und erfolgreich weiterzuentwickeln.
Die Zukunft der Diagnostik seltener Krankheiten liegt in der Verbindung von technologischen Fortschritten und fundiertem Expertenwissen. Nur so können die Möglichkeiten des maschinellen Lernens voll ausgeschöpft werden.
Fazit: Das Potenzial des maschinellen Lernens
Maschinelles Lernen hat die Fähigkeit, die Diagnostik seltener Krankheiten grundlegend zu verändern. Während Patienten oft jahrelang auf eine Diagnose warten und Ärzte mit unübersichtlichen Daten und komplexen Symptomen kämpfen, können Algorithmen genetische Informationen, medizinische Bilder und klinische Texte effizient analysieren. Dabei erkennen sie Muster und Zusammenhänge, die für das menschliche Auge unsichtbar bleiben.
Doch der Erfolg hängt nicht allein von den Algorithmen ab. Es braucht eine durchdachte Planung und strategisches Fachwissen, um maschinelles Lernen effektiv in der Medizin einzusetzen. Jeder Schritt – von der Datensammlung über die Validierung der Modelle bis hin zur Integration in den Klinikalltag – muss sorgfältig gestaltet werden.
Die Zukunft hält noch mehr Möglichkeiten bereit. Fortschritte in der Technologie könnten die Diagnostik weiter präzisieren. Gleichzeitig sorgt erklärbare KI dafür, dass Ärzte und Patienten die Entscheidungen der Algorithmen besser verstehen können, was Vertrauen und Akzeptanz stärkt.
Damit diese Technologien ihr volles Potenzial entfalten, sind nicht nur Forschungsanstrengungen nötig, sondern auch fundierte Beratung. Experten wie Dr. Sven Jungmann unterstützen Organisationen dabei, den digitalen Wandel erfolgreich zu gestalten. Sein Wissen in den Bereichen künstliche Intelligenz und digitale Gesundheit hilft, realistische Erwartungen zu setzen und praktikable Lösungen umzusetzen.
Für Patienten mit seltenen Krankheiten bedeutet das eine neue Perspektive. Maschinelles Lernen kann nicht nur die Diagnostik beschleunigen, sondern auch personalisierte Therapien ermöglichen, die auf die genetischen und individuellen Merkmale jedes Einzelnen zugeschnitten sind.
Wir stehen erst am Anfang dieser Entwicklung, doch die Richtung ist klar: KI wird das Gesundheitswesen verändern – und dabei vor allem denjenigen helfen, die bisher übersehen wurden.
FAQs
Wie hilft maschinelles Lernen dabei, seltene Krankheiten schneller zu diagnostizieren?
Maschinelles Lernen (ML) revolutioniert die Diagnose seltener Krankheiten, indem es riesige Datenmengen durchforstet und dabei Muster erkennt, die menschlichen Augen oft verborgen bleiben. Mit dieser Fähigkeit können Ärzte schneller und gezielter mögliche Diagnosen stellen.
Ein weiterer Vorteil: ML kann Patientendaten mit umfassenden medizinischen Datenbanken abgleichen, um seltene Verbindungen aufzuspüren. So wird es einfacher, spezifische Krankheiten zu identifizieren oder auszuschließen, was den Diagnoseprozess deutlich beschleunigt.
Welche ethischen Herausforderungen gibt es beim Einsatz von maschinellem Lernen zur Behandlung seltener Krankheiten?
Der Einsatz von maschinellem Lernen (ML) bei seltenen Krankheiten bringt einige ethische Herausforderungen mit sich. Eine der größten Sorgen betrifft den Datenschutz, da sensible Gesundheitsdaten oft notwendig sind, um solche Modelle zu entwickeln. Diese Daten sind jedoch besonders schützenswert, was den Umgang damit heikel macht. Zudem besteht die Gefahr, dass ML-Modelle auf unzureichenden oder verzerrten Datensätzen trainiert werden, was zu Diskriminierung und Ungleichheiten in der medizinischen Versorgung führen kann.
Ein weiterer kritischer Punkt ist die fehlende Transparenz vieler ML-Systeme. Oft sind die Entscheidungsprozesse dieser Modelle schwer nachzuvollziehen, was gerade im medizinischen Bereich problematisch ist, wo Vertrauen und Nachvollziehbarkeit eine zentrale Rolle spielen. Hinzu kommt die Frage der Verantwortlichkeit: Wer trägt die Haftung, wenn ein ML-System eine falsche Entscheidung trifft? Schließlich können Modelle, die auf wenig vielfältigen Datensätzen basieren, bei der Anwendung auf unterschiedliche Patientengruppen zu ungenauen Diagnosen führen. Das kann die Qualität der Versorgung erheblich beeinträchtigen.
Wie wird sichergestellt, dass KI-basierte Ergebnisse in der klinischen Praxis zuverlässig und vertrauenswürdig sind?
Die Effektivität von maschinellem Lernen in der klinischen Praxis steht und fällt mit der Zuverlässigkeit und Vertrauenswürdigkeit der Ergebnisse. Hier spielen vor allem drei zentrale Faktoren eine Rolle: Datensicherheit, rechtliche Absicherung und die technische Zuverlässigkeit der eingesetzten Systeme. Nur wenn diese Aspekte erfüllt sind, können KI-gestützte Diagnosehilfen den strengen Anforderungen des Gesundheitswesens gerecht werden.
Doch es geht nicht nur um Technik – Vertrauen ist der Schlüssel. Ärzt_innen und Patient_innen müssen sicher sein, dass die Systeme präzise, sicher und ethisch korrekt arbeiten. Dieses Vertrauen entsteht durch regelmäßige Tests, klare regulatorische Rahmenbedingungen und eine kontinuierliche Überprüfung der zugrundeliegenden Algorithmen. Solche Maßnahmen helfen sicherzustellen, dass KI-Systeme nicht nur technisch funktionieren, sondern auch den hohen ethischen und professionellen Standards im Gesundheitswesen entsprechen.
Verwandte Blogbeiträge
- KI im Gesundheitswesen: 7 praktische Anwendungen
- Machine Learning vs. Deep Learning erklärt
- Wie generative KI seltene Krankheiten schneller erkennt
- KI-gestützte Innovation: Beispiele aus dem Gesundheitswesen
Generative KI in der Arzneimittelanalyse erklärt
Generative KI verändert die Analyse von Arzneimitteln, indem sie Wechselwirkungen besser erkennt und personalisierte Therapien unterstützt. Sie analysiert große Datenmengen, erkennt komplexe Zusammenhänge und hilft dabei, Risiken zu minimieren. In Deutschland wird ihr Einsatz durch strenge Datenschutz- und Sicherheitsvorgaben geregelt, während sie in der Praxis bereits bei der Vorhersage von Wechselwirkungen, der personalisierten Medizin und der Arzneimittelsicherheit Anwendung findet.
Wichtige Punkte:
- Vorhersage von Wechselwirkungen: KI erkennt Risiken, die für Menschen schwer erkennbar sind.
- Personalisierte Medizin: Therapien werden individuell angepasst.
- Pharmakovigilanz: Frühzeitige Erkennung von Sicherheitsproblemen.
- Technologien: Machine Learning, NLP und große Sprachmodelle (LLMs).
- Herausforderungen: Datenqualität, Erklärbarkeit und Integration in bestehende Systeme.
Generative KI bietet großes Potenzial, erfordert aber klare rechtliche Rahmenbedingungen, ethische Abwägungen und moderne IT-Infrastrukturen. Ihre Zukunft liegt in der Kombination verschiedener Datenquellen und der Entwicklung erklärbarer Modelle.
KI in der Medikamentenentwicklung: Prof. Dr. Andrea Volkamer (Charité Berlin)
Wie generative KI in der pharmazeutischen Analyse funktioniert
Generative KI hat das Potenzial, die pharmazeutische Analyse auf ein neues Niveau zu heben. Sie hilft dabei, Arzneimittelanalysen effizienter zu gestalten, indem sie Wechselwirkungen vorhersagt, Therapien individuell anpasst und die Überwachung von Arzneimittelsicherheit verbessert.
Vorhersage von Arzneimittel-Wechselwirkungen
Eine der Stärken generativer KI liegt in der Fähigkeit, riesige Datenmengen zu analysieren. Sie untersucht chemische Eigenschaften, Nebenwirkungen, Stoffwechselwege und klinische Studiendaten, um potenzielle Wechselwirkungen zu erkennen. Besonders bei komplexen Medikamentenkombinationen – etwa bei Patienten, die mehrere Medikamente gleichzeitig einnehmen – kann die KI Muster identifizieren, die für den Menschen schwer zu erkennen sind. Dabei berücksichtigt sie individuelle Faktoren wie Alter, Gewicht, Nierenfunktion und genetische Variationen, um personalisierte Risikoeinschätzungen zu ermöglichen.
Unterstützung der personalisierten Medizin
Die personalisierte Medizin profitiert enorm von der Fähigkeit der KI, individuelle Patientendaten zu analysieren. Genetische Marker, Laborwerte und Behandlungshistorien werden ausgewertet, um Dosierungen und Therapiepläne optimal anzupassen. Doch die KI bleibt nicht bei der Erstdiagnose stehen: Sie überwacht kontinuierlich Verlaufsdaten, um bei unerwarteten Reaktionen oder Nebenwirkungen Anpassungen vorzunehmen. Zusätzlich fließen Daten aus elektronischen Patientenakten ein, wodurch seltene oder langfristige Effekte erkannt und in künftige Empfehlungen integriert werden können.
Verbesserung der Pharmakovigilanz
Die Überwachung der Arzneimittelsicherheit – auch als Pharmakovigilanz bekannt – wird durch KI deutlich effektiver. Sie analysiert kontinuierlich Daten aus elektronischen Patientenakten, Laborberichten und Notaufnahmen, um frühzeitig Warnsignale zu erkennen. Dabei geht sie über offensichtliche Sicherheitsprobleme hinaus: Selbst indirekte Hinweise, wie ein Anstieg bestimmter Laborwerte oder vermehrte Notaufnahmen, können durch automatisierte Analysen aufgedeckt werden. Diese präzisen Einblicke tragen dazu bei, die Patientensicherheit zu verbessern und Risiken im deutschen Gesundheitssystem schneller zu identifizieren und zu minimieren.
Technologien hinter generativer KI in der Arzneimittelanalyse
Die Basis generativer KI in der Arzneimittelanalyse liegt in hochentwickelten Algorithmen und Datenverarbeitungstechniken. Diese ermöglichen es, komplexe pharmazeutische Daten zu entschlüsseln, zu analysieren und daraus verwertbare Informationen zu gewinnen. Im Folgenden werden einige der wichtigsten Technologien genauer beleuchtet.
Machine Learning und Deep Learning Methoden
Neuronale Netzwerke sind das Herzstück moderner KI-Systeme in der Pharmazie. Diese Netzwerke bestehen aus miteinander verbundenen Knoten, die Informationen verarbeiten. Convolutional Neural Networks (CNNs) analysieren beispielsweise molekulare Strukturen und erkennen chemische Muster, während Recurrent Neural Networks (RNNs) zeitliche Muster in Patientendaten nachvollziehen können.
Natural Language Processing (NLP) ist ein weiterer entscheidender Baustein. Diese Technologie extrahiert relevante Informationen aus unstrukturierten Texten wie Studienberichten, Arztbriefen oder Nebenwirkungsmeldungen. Transformer-Modelle, wie sie in NLP eingesetzt werden, können komplexe Verbindungen zwischen Arzneimitteln und ihren Wirkungen erkennen.
Reinforcement Learning wird genutzt, um Therapieempfehlungen zu optimieren. Durch kontinuierliches Lernen aus Behandlungsverläufen passt sich das System dynamisch an, indem es erfolgreichere Ansätze priorisiert. Diese Methode ist besonders hilfreich bei der Dosisanpassung oder der Entwicklung personalisierter Therapiepläne.
Funktionsweise großer Sprachmodelle (LLMs)
Große Sprachmodelle (Large Language Models, LLMs) bieten weit mehr als einfache Textanalysen. Sie können den Kontext medizinischer Begriffe verstehen und Verbindungen zwischen scheinbar isolierten Informationen herstellen.
Die Tokenisierung zerlegt medizinische Texte in ihre kleinsten Bestandteile. Ein Begriff wie "Acetylsalicylsäure" wird nicht nur als Wort erkannt, sondern auch mit bekannten Eigenschaften, Wechselwirkungen und Wirkungen verknüpft. Diese semantische Verarbeitung ermöglicht es, auch subtile Zusammenhänge zu erkennen.
Attention-Mechanismen spielen eine zentrale Rolle bei der Priorisierung relevanter Informationen. Wenn das Modell beispielsweise eine Wechselwirkung zwischen zwei Medikamenten untersucht, richtet es seine Aufmerksamkeit gezielt auf kritische Aspekte wie Stoffwechselwege oder Proteinbindungen. Dieses gezielte Vorgehen führt zu präziseren Analysen und Vorhersagen.
Die Generierung von Erkenntnissen erfolgt durch die Verknüpfung verschiedener Datenquellen. Ein LLM kann beispielsweise klinische Studien, Patientenberichte und molekulare Daten kombinieren, um neue Hypothesen über Arzneimittelwirkungen zu entwickeln. Diese Fähigkeit macht es zu einem wertvollen Werkzeug für die Forschung und klinische Praxis.
Integration mit elektronischen Patientenakten (EPAs)
Die beschriebenen KI-Modelle finden praktische Anwendung durch ihre Integration mit elektronischen Patientenakten (EPAs). Mithilfe von API-Schnittstellen und standardisierten Formaten wie HL7 FHIR wird ein sicherer und effizienter Datenaustausch zwischen KI-Systemen und EPA-Plattformen wie SAP Healthcare oder ORBIS gewährleistet.
Dank dieser Standards können Patientendaten aus unterschiedlichen Quellen einheitlich interpretiert werden. Medikationspläne, Laborwerte oder Diagnosen werden in einem konsistenten Format bereitgestellt, was die Grundlage für zuverlässige Analysen bildet.
Echtzeitverarbeitung ermöglicht es den Systemen, sofort auf neue Daten zu reagieren. Verschreibt ein Arzt ein neues Medikament, prüft die KI binnen Sekunden potenzielle Wechselwirkungen mit bestehenden Medikamenten und gibt gegebenenfalls Warnungen aus.
Die Datenqualität wird durch automatische Validierungsalgorithmen gewährleistet. Diese Algorithmen erkennen unvollständige oder widersprüchliche Einträge und können das medizinische Personal auf mögliche Fehler hinweisen. Da die Genauigkeit der Analysen von der Qualität der Eingangsdaten abhängt, ist diese Funktion essenziell.
Die Workflow-Integration sorgt dafür, dass KI-Empfehlungen direkt in bestehende Arbeitsabläufe eingebunden werden. Ärzte erhalten Hinweise und Warnungen unmittelbar in der gewohnten EPA-Oberfläche, ohne separate Systeme nutzen zu müssen. Dies spart Zeit und erhöht die Akzeptanz der Technologie im klinischen Alltag.
Vorteile und Grenzen generativer KI in der Arzneimittelanalyse
Generative KI bietet spannende Möglichkeiten, bringt aber auch einige Herausforderungen mit sich, die bedacht werden müssen.
Hauptvorteile generativer KI
Generative KI kann die Arzneimittelanalyse in vielerlei Hinsicht verbessern:
- Präzisere Wechselwirkungsanalyse: Im Gegensatz zu traditionellen Systemen, die sich auf bekannte Interaktionen beschränken, können KI-Modelle auch unbekannte Wechselwirkungen durch molekulare Strukturanalysen vorhersagen.
- Hohe Skalierbarkeit: Millionen von Patientendaten können gleichzeitig verarbeitet werden. Dabei berücksichtigt die KI individuelle Faktoren wie Alter und genetische Marker, um komplexe Medikationspläne in Sekunden zu analysieren.
- Zeitersparnis: Echtzeit-Analysen ersetzen langwierige manuelle Recherchen. Ärzte erhalten sofort Warnungen bei potenziell problematischen Verschreibungen.
- Personalisierte Medizin: Durch die Analyse individueller Patientenprofile und genetischer Daten können maßgeschneiderte Therapieempfehlungen erstellt werden.
- Kontinuierliches Lernen: Die Systeme verbessern sich ständig, indem sie aus neuen Patientendaten lernen, was die Genauigkeit weiter erhöht.
Trotz dieser Vorteile gibt es jedoch auch Herausforderungen, die den Einsatz generativer KI einschränken können.
Aktuelle Einschränkungen und Herausforderungen
Die beeindruckenden Stärken der generativen KI stehen einigen wesentlichen Hindernissen gegenüber:
- Datenqualität und -verfügbarkeit: Unvollständige oder inkonsistente Patientenakten können zu fehlerhaften Vorhersagen führen.
- Erklärbarkeit der KI-Entscheidungen: Häufig ist es schwer nachzuvollziehen, warum die KI bestimmte Warnungen ausspricht. Das erschwert die ärztliche Bewertung und das Vertrauen in die Technologie.
- Regulatorische Hürden: Die Zulassung durch Institutionen wie das BfArM ist ein langwieriger Prozess, der oft Jahre in Anspruch nimmt.
- Technische Integration: Viele Einrichtungen arbeiten mit veralteten IT-Systemen, was die Implementierung neuer Technologien teuer und kompliziert macht.
| Vorteile | Einschränkungen |
|---|---|
| Genauigkeit: Erkennung unbekannter Wechselwirkungen | Datenqualität: Ungenaue Vorhersagen durch fehlerhafte Daten |
| Skalierbarkeit: Analyse von Millionen Patientendaten | Erklärbarkeit: Schwer nachvollziehbare Entscheidungen |
| Zeitersparnis: Sofortige Warnungen in Echtzeit | Regulierung: Langwierige Zulassungsverfahren |
| Personalisierung: Maßgeschneiderte Therapieempfehlungen | Integration: Probleme mit veralteten IT-Systemen |
| Kontinuierliches Lernen: Ständige Verbesserung | Kosten: Hohe Investitionen für die Implementierung |
Zusätzlich zu diesen Herausforderungen spielen Datenschutz, Haftungsfragen und ethische Überlegungen eine zentrale Rolle. Die Abhängigkeit von Technologie birgt Risiken, etwa bei Systemausfällen, während ungeklärte Fragen zur Validierung und Haftung bestehen, wenn KI-Empfehlungen zu Patientenschäden führen. Solche Themen verlangen klare Regelungen und sorgfältige Abwägungen, bevor generative KI flächendeckend eingesetzt werden kann.
sbb-itb-49a712f
Regulatorische und Implementierungsanforderungen
Der Einsatz generativer KI in der Arzneimittelanalyse erfordert klare rechtliche Rahmenbedingungen und durchdachte praktische Ansätze.
Regulierung von KI im Gesundheitswesen
Die Medizinprodukteverordnung (MDR) bildet die Grundlage für die Regulierung von KI-Systemen im Gesundheitssektor. Generative KI-Tools, die in der Arzneimittelanalyse eingesetzt werden, fallen unter die Kategorie der Medizinprodukte. Ihre Klassifizierung, beispielsweise als Klasse IIa oder IIb, hängt vom jeweiligen Verwendungszweck und dem damit verbundenen Risikopotenzial ab. Behörden wie das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) bewerten diese Systeme hinsichtlich Sicherheit, Wirksamkeit und klinischem Nutzen. Hersteller müssen gewährleisten, dass ihre Produkte die geltenden Qualitäts- und Sicherheitsstandards erfüllen. Zusätzlich zur MDR ist der Schutz sensibler Patientendaten eine zentrale Herausforderung.
Datenschutz- und Sicherheitsanforderungen
Die Datenschutz-Grundverordnung (DSGVO) setzt strenge Maßstäbe für KI-Systeme, die mit Gesundheitsdaten arbeiten. Da Patientendaten als besonders schützenswert gelten, dürfen sie nur mit ausdrücklicher Einwilligung verarbeitet werden. Techniken wie Pseudonymisierung, Differential Privacy und Ende-zu-Ende-Verschlüsselung sind essenziell, um diese Daten zu schützen.
Auch die Datenhoheit spielt eine entscheidende Rolle: Gesundheitsdaten sollten bevorzugt innerhalb der EU verarbeitet werden. Viele deutsche Krankenhäuser setzen deshalb auf On-Premise-Lösungen oder Private-Cloud-Umgebungen, um die Kontrolle über sensible Informationen zu behalten. Neben technischen Sicherheitsmaßnahmen müssen auch ethische und rechtliche Aspekte berücksichtigt werden.
Ethik- und Sicherheitsüberlegungen
Ein wichtiger ethischer Schwerpunkt bei der Nutzung generativer KI ist die algorithmische Fairness. Systeme dürfen keine systematischen Benachteiligungen bestimmter Patientengruppen verursachen, sei es aufgrund von Alter, Geschlecht, Herkunft oder sozialem Status. Um Verzerrungen zu erkennen und zu beheben, sind regelmäßige Bias-Audits notwendig.
Die Verantwortung für medizinische Entscheidungen bleibt weiterhin bei den Ärzten. KI-Systeme dienen lediglich als unterstützende Werkzeuge, deren Empfehlungen stets durch Fachpersonal geprüft werden müssen. Deshalb sind sogenannte Human-in-the-Loop-Prozesse entscheidend, bei denen die finale Entscheidung immer beim Menschen liegt.
Die Sicherheit der Patienten hat höchste Priorität. Generative KI-Systeme müssen mit Fail-Safe-Mechanismen ausgestattet sein, die bei unklaren oder widersprüchlichen Daten Warnungen auslösen. Zudem sind kontinuierliche Monitoring-Systeme erforderlich, um die Leistung der KI in Echtzeit zu überwachen und schnell auf Abweichungen reagieren zu können.
Patienten müssen transparent informiert werden, wenn KI-Systeme in ihre Behandlung integriert werden. Sie haben das Recht, der Nutzung ihrer Daten zu widersprechen. Krankenhäuser sollten leicht verständliche Informationsmaterialien bereitstellen, die den Einsatz von KI und deren Vorteile erklären.
Klare Haftungsregelungen und entsprechende Versicherungen sind unerlässlich, um Risiken, die aus KI-Empfehlungen entstehen könnten, abzusichern. All diese Maßnahmen zielen darauf ab, die Patienten zu schützen und den Einsatz von KI nachhaltig in den klinischen Alltag zu integrieren.
Zukunft der generativen KI in der Arzneimittelanalyse
Die Anwendung generativer KI in der Arzneimittelanalyse befindet sich noch in einer frühen Phase, zeigt jedoch bereits beeindruckende Möglichkeiten. Während sich die regulatorischen Vorgaben weiterentwickeln, arbeiten Wissenschaftler und Unternehmen an wegweisenden Lösungen, die das Gesundheitswesen nachhaltig verändern könnten. Die bisherigen Fortschritte schaffen die Grundlage für tiefere Forschungsansätze, wie im Folgenden beschrieben.
Aktuelle Forschung und Entwicklung
In Deutschland treiben Universitätskliniken und Forschungsinstitute Pilotprojekte voran, die darauf abzielen, die Sicherheit von Medikamenten zu verbessern. Dabei wird untersucht, wie generative KI-Modelle komplexe Wechselwirkungen zwischen Medikamenten erkennen können – ein Bereich, der selbst für erfahrene Experten oft schwer überschaubar ist.
Besonders spannend sind multimodale KI-Systeme, die verschiedene Datenquellen gleichzeitig analysieren. Diese Systeme kombinieren Informationen aus elektronischen Gesundheitsakten, molekulare Daten und genetische Profile, um umfassende Vorhersagemodelle zu entwickeln.
Ein weiterer Schwerpunkt liegt auf der Integration von Real-World-Evidence. Durch die Analyse großer Datenmengen aus realen Behandlungsszenarien können KI-Systeme lernen, wie Medikamente tatsächlich wirken. Diese Erkenntnisse ergänzen die Ergebnisse aus kontrollierten Studien und führen zu präziseren Vorhersagen.
Auch die Entwicklung erklärbarer KI-Systeme nimmt Fahrt auf. Diese Systeme können nicht nur Empfehlungen aussprechen, sondern auch die zugrunde liegenden Entscheidungsprozesse verständlich erläutern. Für Ärzte ist dies ein entscheidender Vorteil, um die von der KI vorgeschlagenen Maßnahmen besser bewerten zu können.
KI in der Arzneimittelentdeckung und -entwicklung
Die Fortschritte in der Arzneimittelanalyse ebnen den Weg für den Einsatz generativer KI in der Wirkstoffentwicklung. KI-Systeme analysieren nicht nur bestehende Medikamente, sondern unterstützen auch die Entwicklung neuer Wirkstoffkandidaten. Mithilfe von Algorithmen können sie Moleküle mit spezifischen Eigenschaften entwerfen und so die Effizienz der Forschung erheblich steigern.
Ein wichtiger Vorteil liegt in der verbesserten Vorhersage von Nebenwirkungen. Während unerwünschte Wirkungen in der Vergangenheit oft erst in späten klinischen Phasen entdeckt wurden, können KI-Modelle potenzielle Risiken bereits bei der Auswahl von Wirkstoffen identifizieren. Das spart nicht nur Zeit und Kosten, sondern erhöht auch die Sicherheit für Patienten.
Darüber hinaus optimiert KI die Durchführung klinischer Studien. Durch eine KI-gestützte Auswahl von Studienteilnehmern und ein besseres Studiendesign können Unternehmen die Erfolgsaussichten ihrer Studien erheblich verbessern. KI-Systeme helfen dabei, die Patienten zu identifizieren, die am wahrscheinlichsten auf bestimmte Behandlungen ansprechen.
Experteneinblicke von Dr. Sven Jungmann
Technologische Fortschritte allein reichen nicht aus – es braucht praxisorientiertes Wissen, um die Möglichkeiten der KI voll auszuschöpfen. Dr. Sven Jungmann liefert mit seinen Vorträgen und Beratungen wertvolle Einblicke in die praktische Anwendung von KI im Gesundheitswesen. Sein Fachwissen umfasst sowohl technische Aspekte der KI als auch strategische und organisatorische Herausforderungen, die mit der digitalen Transformation einhergehen.
Dr. Jungmann legt besonderen Wert auf Innovationsführung bei der Einführung neuer KI-Systeme. Die erfolgreiche Integration generativer KI in bestehende Prozesse erfordert durchdachte Strategien für das Veränderungsmanagement sowie gezielte Schulungen des Fachpersonals. Mit seinen praxiserprobten Ansätzen unterstützt er Organisationen dabei, das volle Potenzial der Technologie auszuschöpfen.
Die Modernisierung der IT-Infrastruktur wird für Krankenhäuser und Pharmaunternehmen immer wichtiger. Dr. Jungmanns Fachkompetenz in den Bereichen Big Data und digitale Plattformen hilft Organisationen, fundierte technologische Entscheidungen zu treffen und häufige Fehler bei der Implementierung zu vermeiden.
Seine Expertise in der Anwendung von KI im Gesundheitswesen bietet konkrete Lösungen für zentrale Herausforderungen der Arzneimittelanalyse. Dazu zählen Themen wie Datenqualität, Systemintegration und die Akzeptanz neuer Technologien durch die Nutzer. Organisationen, die auf seine Beratungsleistungen zurückgreifen, profitieren von bewährten Praktiken und können typische Hindernisse erfolgreich umgehen.
Die Zukunft der generativen KI in der Arzneimittelanalyse hängt entscheidend davon ab, wie gut Organisationen diese Technologien implementieren und nutzen können. Strategische Beratung wird daher zu einem Schlüsselfaktor, um die Möglichkeiten dieser bahnbrechenden Technologie voll auszuschöpfen.
Fazit
Generative KI verändert die Arzneimittelanalyse grundlegend und eröffnet neue Möglichkeiten für sicherere und präzisere Therapien. Ihre Stärke liegt vor allem in der Fähigkeit, komplexe Zusammenhänge zwischen Arzneimitteln zu analysieren und diese Informationen in elektronische Gesundheitsakten einzubinden. Das Ergebnis? Bessere, individuell angepasste Therapieentscheidungen und eine frühzeitige Erkennung von Risiken.
Regulatorische Vorgaben und Datenschutz bleiben dabei entscheidende Faktoren für die Umsetzung. Das deutsche Gesundheitssystem arbeitet an Rahmenbedingungen, die sowohl Innovation als auch die Sicherheit von Patienten gewährleisten sollen. Diese Herausforderungen prägen den Weg für zukünftige Entwicklungen.
Mit multimodalen KI-Systemen, die Daten aus verschiedenen Quellen kombinieren, werden Vorhersagen immer präziser. Gleichzeitig sorgt die Weiterentwicklung von erklärbaren KI-Modellen dafür, dass Ärzte und Patienten mehr Vertrauen in die Technologie gewinnen können.
Damit generative KI erfolgreich eingesetzt werden kann, sind moderne IT-Infrastrukturen, gezielte Schulungen und ein durchdachtes Veränderungsmanagement unumgänglich.
Die Arzneimittelanalyse durchläuft eine digitale Transformation, die das Potenzial hat, die Patientenversorgung nachhaltig zu verbessern. Organisationen, die bereits jetzt in generative KI investieren, sichern sich nicht nur einen Vorsprung, sondern auch die Möglichkeit, die Vorteile dieser Technologie langfristig zu nutzen.
FAQs
Wie sorgt generative KI in der Arzneimittelanalyse für den Schutz von Patientendaten?
Generative KI hat das Potenzial, die Analyse von Arzneimittelwechselwirkungen grundlegend zu verändern. Doch bei all den Möglichkeiten, die diese Technologie bietet, muss der Schutz sensibler Patientendaten stets an erster Stelle stehen. Der verantwortungsvolle Einsatz solcher Systeme erfordert nicht nur technisches Know-how, sondern auch ein klares Bewusstsein für Datenschutz und Sicherheit.
Ein entscheidender Schritt ist die Anonymisierung der Daten, bevor diese verarbeitet werden. So wird sichergestellt, dass keine Rückschlüsse auf einzelne Personen möglich sind. Gleichzeitig müssen robuste Sicherheitsmaßnahmen etabliert werden, um unbefugten Zugriff auf die Daten zu verhindern. Das bedeutet: Verschlüsselung, regelmäßige Sicherheitsprüfungen und der Einsatz modernster Technologien zum Schutz vor Cyberangriffen.
Doch Technik allein reicht nicht aus. Eine menschliche Überprüfung der Ergebnisse bleibt unverzichtbar, um mögliche Verzerrungen oder Fehler in der Analyse zu erkennen. KI-Systeme können zwar beeindruckend leistungsfähig sein, aber sie sind nicht unfehlbar. Deshalb sollten Unternehmen klare Prozesse und Richtlinien entwickeln, die sowohl den gesetzlichen Vorgaben entsprechen als auch die eigenen Datenschutzstandards einhalten.
Nur durch diese Kombination aus technischer Präzision und menschlicher Kontrolle kann sichergestellt werden, dass generative KI verantwortungsvoll eingesetzt wird – zum Nutzen der Patienten und ohne Kompromisse beim Datenschutz.
Welche Herausforderungen gibt es bei der Einführung generativer KI im Gesundheitssystem und wie können diese gelöst werden?
Die Einführung generativer KI im Gesundheitssystem bringt einige Herausforderungen mit sich. Eine der größten Hürden ist die Verfügbarkeit und Qualität der Daten. KI-Modelle benötigen riesige Mengen an präzisen und gut aufbereiteten Informationen, um effektiv zu arbeiten. Besonders wichtig sind hierbei Daten aus elektronischen Patientenakten oder von Krankenkassen. Ohne solche hochwertigen Datensätze bleibt das Potenzial von KI stark eingeschränkt. Gleichzeitig stellt eine veraltete IT-Infrastruktur ein erhebliches Hindernis dar, da moderne KI-Systeme leistungsfähige Technologien und eine robuste digitale Basis voraussetzen.
Ein weiterer komplexer Bereich sind die regulatorischen Anforderungen. Um mit den rasanten Entwicklungen im Bereich der KI Schritt zu halten, braucht es klare Standards für die Validierung von KI-Daten sowie angepasste Zulassungsverfahren. Doch damit nicht genug: Auch Themen wie Datenschutz, Haftungsfragen und ethische Überlegungen müssen umfassend geklärt werden, um Vertrauen in die Technologie aufzubauen und ihre Akzeptanz zu fördern.
Ansätze wie der European Health Data Space (EHDS) und das Gesundheitsdatennutzungsgesetz (GDNG) in Deutschland könnten dazu beitragen, den Zugang zu relevanten Gesundheitsdaten zu erleichtern. Allerdings ist es entscheidend, dass solche Initiativen durch klare rechtliche Rahmenbedingungen untermauert werden. Nur so lässt sich eine Balance zwischen Innovation und dem Schutz sensibler Daten finden.
Wie können Ärzte und Patienten sicherstellen, dass generative KI verlässliche und transparente Therapieempfehlungen liefert?
Um sicherzustellen, dass Therapieempfehlungen von generativer KI zuverlässig und nachvollziehbar sind, sollten sowohl Ärzte als auch Patienten einige wichtige Punkte beachten. Medizinisches Fachpersonal sollte die Vorschläge der KI stets kritisch hinterfragen und sie im Kontext der individuellen Bedürfnisse und Gesundheitsdaten des Patienten bewerten. Dabei spielt es eine zentrale Rolle, die Funktionsweise der zugrunde liegenden Algorithmen zu verstehen und auf deren Transparenz zu achten.
Es ist ebenso entscheidend, ausschließlich KI-Systeme einzusetzen, die auf einer soliden wissenschaftlichen Grundlage basieren und deren Ergebnisse klar dokumentiert sind. Die Kombination aus menschlicher Expertise und KI-gestützten Analysen bietet die Möglichkeit, die Qualität und Sicherheit von Therapieempfehlungen deutlich zu verbessern.
Verwandte Blogbeiträge
- KI im Gesundheitswesen: 7 praktische Anwendungen
- Generative KI für klinische Evidenzsynthese
- Wie generative KI Ärzte bei Diagnosen unterstützt
- Generative KI für Multi-Target-Wirkstoffdesign
Wie KI Interoperabilität im Gesundheitswesen beschleunigt
Künstliche Intelligenz (KI) verändert den Austausch von Gesundheitsdaten grundlegend. Sie hilft, isolierte Datensilos aufzulösen, Datenformate zu vereinheitlichen und Informationen in Echtzeit bereitzustellen. Damit unterstützt sie Ärzte bei schnelleren und präziseren Entscheidungen. Trotz technischer, rechtlicher und organisatorischer Hürden zeigt sich bereits, wie KI den Datenaustausch effizienter gestaltet und die Patientenversorgung verbessert.
Wichtigste Punkte:
- Automatisierung: KI standardisiert Datenformate (z. B. FHIR) und wandelt unstrukturierte Informationen wie Arztbriefe um.
- Semantik: Machine Learning erkennt Bedeutungen, auch bei unterschiedlichen Begriffen, und verbessert Vorhersagen.
- Echtzeitdaten: KI-Systeme liefern Ärzten sofort relevante Informationen, besonders in Notfällen.
- Herausforderungen: Veraltete IT-Systeme, Datenschutzanforderungen (DSGVO) und organisatorischer Widerstand bremsen die Umsetzung.
- Zukunft: Multimodale Datenintegration, Federated Learning und Blockchain stärken Datensicherheit und Zusammenarbeit.
KI bietet große Chancen, erfordert aber Zusammenarbeit zwischen Kliniken, IT-Experten und Politik. Mit gezielter Weiterbildung und neuen Technologien kann das Gesundheitssystem effizienter und vernetzter werden.
Mit KI das Leben von Patient:innen verbessern.
Wie KI den Datenaustausch im Gesundheitswesen ermöglicht
Künstliche Intelligenz (KI) schafft Verbindungen zwischen verschiedenen Systemen und löst zentrale Herausforderungen im Gesundheitswesen. Hier zeigen wir, wie diese Technologien praktisch umgesetzt werden.
1. KI-gestützte Datenintegration und Standardisierung
Die automatische Harmonisierung von Datenformaten bildet das Rückgrat moderner Interoperabilität. KI-Systeme können Daten aus elektronischen Patientenakten, bildgebenden Verfahren oder Genomikdaten erkennen und in einheitliche Standards wie FHIR (Fast Healthcare Interoperability Resources) oder IHE (Integrating the Healthcare Enterprise) überführen.
Ein weiteres Beispiel ist der Einsatz von Natural Language Processing (NLP), das unstrukturierte Daten wie Arztbriefe in standardisierte Formate umwandelt. Früher mussten IT-Experten jede neue Systemintegration manuell programmieren. Heute lernen KI-Systeme eigenständig und integrieren neue Datenquellen automatisch.
2. Semantische Datenzuordnung und Machine Learning
Die semantische Analyse geht über die reine Formatangleichung hinaus. Machine Learning-Modelle verstehen die Bedeutung von Daten, selbst wenn Begriffe unterschiedlich benannt oder strukturiert sind. So erkennt KI etwa, dass „Geburtsdatum“ und „DOB“ dasselbe meinen.
Deep Learning-Algorithmen gehen noch einen Schritt weiter: Sie analysieren fragmentierte Datensätze, entdecken Muster und verbessern kontinuierlich ihre Vorhersagen. Diese Technologie ermöglicht personalisierte Diagnosen und Therapien, indem sie Risikofaktoren aus verschiedenen Quellen kombiniert und Krankheitsverläufe prognostiziert.
Mit jedem verarbeiteten Datensatz werden Zuordnungen und Vorhersagen präziser. Das Resultat ist eine Infrastruktur, die sich selbst optimiert und mit der Zeit effizienter wird.
3. Echtzeit-Datenaustausch für klinische Entscheidungen
Echtzeitdaten spielen eine Schlüsselrolle in der klinischen Entscheidungsfindung. KI-Systeme kombinieren Patientendaten aus verschiedenen Quellen und stellen Ärzten relevante Informationen sofort zur Verfügung – eine unverzichtbare Unterstützung, besonders in Notfällen.
Klinische Entscheidungsunterstützungssysteme (CDSS) nutzen Echtzeitdaten, um Entscheidungen zu beschleunigen und automatische Warnmeldungen auszulösen. Dabei berücksichtigen sie Laborwerte, Medikamenteninteraktionen, Allergien und Vorerkrankungen gleichzeitig – ein Aufwand, der manuell kaum zu bewältigen wäre.
Zusätzlich verbessert KI die Workflow-Organisation, indem sie Aufgaben priorisiert. Sie analysiert die Dringlichkeit und Relevanz von Patientenfällen, was dem medizinischen Personal hilft, Zeit effizienter einzusetzen. Das entlastet ein ohnehin stark beanspruchtes Gesundheitssystem erheblich.
Barrieren für KI-gestützten Datenaustausch
Trotz zahlreicher Vorteile der KI im Gesundheitswesen gibt es mehrere Hindernisse, die ihre breite Anwendung erschweren. Diese Herausforderungen betreffen vor allem technische, rechtliche und organisatorische Bereiche und erfordern abgestimmte Lösungsansätze. Im Folgenden werden die zentralen Barrieren näher betrachtet.
1. Technische Probleme: Datensilos und veraltete Systeme
Die IT-Infrastruktur im Gesundheitswesen ist oft fragmentiert, was den Datenaustausch erheblich erschwert. Viele Einrichtungen arbeiten weiterhin mit älteren Systemen, die für den Einsatz moderner KI-Technologien nicht geeignet sind.
Ein großes Problem stellen sogenannte Datensilos dar. Hierbei speichern verschiedene Abteilungen oder Institutionen ihre Daten isoliert voneinander. Ein Beispiel: Radiologie, Pathologie und Kardiologie nutzen oft jeweils eigene IT-Systeme, die nicht miteinander verbunden sind – obwohl sie Informationen über denselben Patienten verwalten.
Die fehlende Standardisierung verstärkt diese Probleme zusätzlich. KI-Lösungen müssen häufig individuell angepasst werden, um Daten aus unterschiedlichen Quellen verarbeiten zu können.
In ländlichen Regionen kommt eine weitere Hürde hinzu: Die Netzwerkinfrastruktur ist oft nicht ausreichend, um große Datenmengen in Echtzeit auszutauschen.
2. Regulatorische und ethische Herausforderungen
Neben technischen Aspekten gibt es auch rechtliche und ethische Hürden, die den Einsatz von KI erschweren. Die Datenschutz-Grundverordnung (DSGVO) stellt strenge Regeln für den Umgang mit Gesundheitsdaten auf. KI-Anwendungen müssen transparent machen, wie sie personenbezogene Daten verarbeiten, speichern und schützen. Dies erfordert oft aufwendige Datenschutz-Folgenabschätzungen und das Einholen von Einverständniserklärungen.
Ein weiteres Problem ist die mangelnde Transparenz vieler KI-Systeme. Oft werden sie als „Black Box“ wahrgenommen, was das Vertrauen von Ärzten und Patienten beeinträchtigt.
Auch die Frage der Haftung ist ungeklärt: Wer übernimmt die Verantwortung, wenn eine KI-gestützte Diagnose fehlerhaft ist? Zudem gibt es ethische Bedenken, dass unausgewogene Datensätze bestehende Vorurteile in den Algorithmen verstärken könnten.
3. Organisatorischer Widerstand
Neben technischen und rechtlichen Barrieren gibt es auch Widerstände innerhalb der Organisationen. Im Gesundheitswesen herrscht oft Skepsis gegenüber neuen Technologien. Viele Ärzte und Pflegekräfte befürchten, dass KI ihre Fachkenntnisse infrage stellt oder zusätzlichen Arbeitsaufwand verursacht.
Ein weiteres Hindernis ist der Mangel an digitalen Kompetenzen. Ohne ausreichende Schulungen fällt es dem Personal schwer, komplexe KI-Anwendungen effektiv zu nutzen. Hinzu kommen knappe Budgets und Zurückhaltung bei Investitionen, die die Modernisierung der IT-Infrastruktur verzögern.
Auch der kulturelle Wandel in traditionell hierarchisch organisierten Einrichtungen verläuft oft langsam. Langwierige Genehmigungsprozesse und institutionelle Trägheit bremsen Innovationen. Zudem erschwert die fehlende Zusammenarbeit zwischen IT-Experten und medizinischem Personal die Entwicklung praxisnaher Lösungen und führt häufig zu Kommunikationsproblemen.
Fallstudien: Beispiele für KI-gestützten Datenaustausch
Die vorgestellten Methoden der Künstlichen Intelligenz (KI) werden bereits aktiv genutzt – wie die folgenden Praxisbeispiele und Forschungsergebnisse zeigen. Verschiedene Initiativen in Deutschland und Europa demonstrieren, wie Gesundheitsdaten effizienter und strukturierter integriert werden können, um relevante Informationen schneller bereitzustellen.
Beispiele aus Deutschland und Europa
Ein zentraler Fortschritt in Deutschland ist die elektronische Patientenakte (ePA). Sie zeigt eindrucksvoll, wie KI-Algorithmen genutzt werden können, um unterschiedliche Datenformate zu vereinheitlichen und Daten aus verschiedensten Quellen automatisiert aufzubereiten. Pilotprojekte in ausgewählten Kliniken haben bewiesen, dass KI eine standardisierte Datenintegration zwischen medizinischen Einrichtungen ermöglicht und so die Zusammenarbeit erleichtert.
Auch auf europäischer Ebene werden KI-gestützte Lösungen getestet, um Gesundheitsdaten grenzüberschreitend zu harmonisieren. Solche Projekte senken den Verwaltungsaufwand erheblich und stellen sicher, dass kritische Patientendaten schneller verfügbar sind – ein wichtiger Schritt für eine effizientere Gesundheitsversorgung.
Forschungsergebnisse zur Rolle der KI beim Datenaustausch
Studien belegen die positiven Auswirkungen von KI auf die Interoperabilität im Gesundheitswesen. Sie zeigen, dass KI dabei hilft, isolierte Datensilos zu überwinden, den manuellen Aufwand zu minimieren und die Übertragung von Daten spürbar zu verbessern. Dies trägt maßgeblich dazu bei, eine qualitativ hochwertige medizinische Versorgung zu gewährleisten.
Diese Fallstudien und Forschungsergebnisse verdeutlichen, wie KI die Zusammenarbeit zwischen Gesundheitsdienstleistern optimieren und die Digitalisierung im Gesundheitswesen vorantreiben kann.
sbb-itb-49a712f
Vor- und Nachteile des KI-gestützten Datenaustauschs
Die Integration von KI im Gesundheitswesen bringt sowohl Vorteile als auch Herausforderungen mit sich. Eine genaue Abwägung dieser Aspekte ist entscheidend, um fundierte Entscheidungen zu treffen.
Zu den Hauptvorteilen zählen die deutliche Reduzierung manueller Aufgaben, die Verbesserung der Datenqualität durch automatisierte Validierungsprozesse und die Beschleunigung klinischer Entscheidungen. Diese Vorteile können den Arbeitsalltag im Gesundheitswesen erheblich erleichtern und die Effizienz steigern.
Dennoch gibt es auch Herausforderungen. KI-Systeme erfordern regelmäßige Updates, spezialisierte Fachkräfte und bergen Risiken durch mögliche Fehler in den Algorithmen. Besonders problematisch ist die Abhängigkeit von der Datenqualität – ungenaue oder unvollständige Eingangsdaten führen zwangsläufig zu fehlerhaften Ergebnissen.
Ein weiterer kritischer Punkt ist die Transparenz der Entscheidungsfindung. Während regelbasierte Systeme nachvollziehbare Ergebnisse liefern, können Machine-Learning-Modelle durch ihre Komplexität wie eine "Black Box" wirken, was das Vertrauen des medizinischen Personals beeinträchtigen könnte.
Im Folgenden werden die Vor- und Nachteile verschiedener KI-Ansätze genauer beleuchtet.
Vergleich der KI-Ansätze
Die unterschiedlichen KI-Ansätze zur Förderung der Interoperabilität haben jeweils spezifische Stärken, Schwächen und Anwendungsbereiche. Die folgende Tabelle bietet einen Überblick:
| Ansatz | Vorteile | Einschränkungen | Anwendungsbereiche |
|---|---|---|---|
| Regelbasierte Systeme | Einfach, nachvollziehbar, schnell implementierbar | Begrenzte Skalierbarkeit, erfordert manuelle Anpassungen | Kleine Gesundheitseinrichtungen, standardisierte Abläufe |
| Machine-Learning-Modelle | Flexibel, skalierbar, selbstlernend | Komplex, datenabhängig, schwer interpretierbar | Große Krankenhäuser, komplexe Datenharmonisierung |
| Zentralisierte Modelle | Effizient, zentrale Kontrolle, einheitliche Standards | Risiko eines zentralen Ausfalls, Datenschutzprobleme | Nationale Gesundheitsplattformen, elektronische Patientenakten (ePA) |
| Föderierte Modelle | Datenschutzfreundlich, robust, lokale Kontrolle | Schwierige Koordination, langsamere Implementierung | Grenzüberschreitender Datenaustausch, Forschungsprojekte |
Regelbasierte Systeme eignen sich ideal für einfache, klar definierte Prozesse mit wenigen Variablen. Sie sind kostengünstig und bieten eine hohe Transparenz, stoßen jedoch bei komplexen Datenstrukturen schnell an ihre Grenzen.
Machine-Learning-Modelle kommen vor allem bei großen Datenmengen und unstrukturierten Informationen zum Einsatz. Sie können Muster erkennen, die für Menschen schwer zu identifizieren sind, erfordern jedoch umfangreiche Trainingsdaten und eine kontinuierliche Überwachung.
Die Wahl zwischen zentralisierten und föderierten Ansätzen hängt stark von den organisatorischen und regulatorischen Anforderungen ab. Zentralisierte Modelle ermöglichen schnellere Abläufe, während föderierte Modelle den Datenschutz stärken und bei beteiligten Institutionen oft auf größere Akzeptanz stoßen.
Der wirtschaftliche Nutzen variiert je nach Größe und IT-Struktur der Organisation. Kleinere Einrichtungen profitieren in der Regel von einfachen, regelbasierten Systemen, während große Krankenhausverbünde das Potenzial von Machine-Learning-Technologien besser ausschöpfen können. Dieser Vergleich zeigt, wie unterschiedliche KI-Ansätze gezielt zur Verbesserung der Interoperabilität beitragen können.
Zukunftstrends für KI und Datenaustausch im Gesundheitswesen
Die Interoperabilität im Gesundheitswesen, unterstützt durch KI, steht an einem Wendepunkt. Mit bahnbrechenden Technologien, engeren Kooperationen und gezielter Weiterbildung verändert sich der Austausch medizinischer Daten grundlegend. Im Folgenden werfen wir einen genaueren Blick auf die wichtigsten Entwicklungen.
1. Neue Technologien und Trends
Foundation Models bringen eine neue Effizienz in die Verarbeitung medizinischer Daten. Diese Modelle können unterschiedliche Datenformate nahtlos übersetzen, ohne dass separate Schnittstellen erforderlich sind. Damit lösen sie punktuelle Lösungen ab und schaffen eine einheitliche Grundlage für den Datenaustausch.
Die multimodale Datenintegration geht noch einen Schritt weiter: Sie kombiniert verschiedenste Datentypen wie Röntgenaufnahmen, Laborergebnisse, Arztberichte und Vitaldaten in einem einzigen System. Das Ergebnis? Ein umfassendes und vernetztes Patientenbild, das die Diagnose und Behandlung verbessert.
Federated Learning erfüllt strengste Datenschutzanforderungen, indem Patientendaten lokal bleiben und nur die Erkenntnisse der Algorithmen geteilt werden. Kliniken können so voneinander lernen, ohne sensible Informationen preiszugeben.
Mit Edge Computing werden Daten direkt vor Ort verarbeitet, wodurch Latenzzeiten minimiert und die Datensicherheit erhöht werden.
Blockchain-Technologien bieten eine unveränderliche Dokumentation aller Datenänderungen. Das stärkt das Vertrauen in die Sicherheit und Zuverlässigkeit der Systeme.
Diese Technologien schaffen die Grundlage für eine intensivere Zusammenarbeit zwischen verschiedenen Akteuren im Gesundheitswesen.
2. Sektorübergreifende Zusammenarbeit
Damit KI-Systeme im Gesundheitswesen erfolgreich integriert werden können, ist eine enge Kooperation aller Beteiligten erforderlich. Kliniker, Technologieunternehmen und politische Entscheidungsträger müssen an einem Strang ziehen.
Forschungseinrichtungen spielen eine Schlüsselrolle, indem sie neue Algorithmen entwickeln und validieren. Besonders die Zusammenarbeit zwischen Universitätskliniken und Technologieunternehmen beschleunigt den Transfer von der Theorie in die Praxis.
Politische Unterstützung ist ebenfalls entscheidend. Gesetzgeber müssen Rahmenbedingungen schaffen, die sowohl Innovation als auch Patientensicherheit fördern. Die Digitalisierungsstrategie des Bundesgesundheitsministeriums zeigt erste Fortschritte in diese Richtung.
Auf europäischer Ebene ist eine Harmonisierung der Standards unerlässlich. Initiativen wie der European Health Data Space der EU legen den Grundstein für einen einheitlichen Umgang mit Gesundheitsdaten.
Auch Partnerschaften zwischen etablierten Gesundheitsunternehmen und KI-Startups spielen eine wichtige Rolle. Sie bringen innovative Lösungen schneller auf den Markt und fördern die Einführung neuer Technologien.
Diese Zusammenarbeit bildet die Grundlage für eine gezielte Schulung und Beratung der Anwender.
3. Expertenberatung und Bildung
Der Erfolg von KI-Systemen hängt maßgeblich von den Fähigkeiten der Menschen ab, die sie nutzen. Medizinisches Personal muss die Funktionsweise der Systeme verstehen und ihre Grenzen kennen.
Dr. Sven Jungmann, ein Experte für digitale Gesundheit, bietet praxisnahe Vorträge und Schulungen an, die Organisationen bei der digitalen Transformation unterstützen. Solche Angebote vermitteln wertvolle Einblicke in den Umgang mit KI.
Regelmäßige Weiterbildungen sind unverzichtbar, um sicherzustellen, dass Anwender die Technologie korrekt bedienen und deren Möglichkeiten sowie Einschränkungen verstehen.
Ein erfolgreicher Einsatz von KI erfordert zudem ein durchdachtes Change Management, das Mitarbeiter frühzeitig einbindet und den Übergang schrittweise gestaltet.
Schulungsprogramme sollten auch ethische Aspekte berücksichtigen, wie beispielsweise die Vermeidung von Vorurteilen und diskriminierenden Entscheidungen.
Interdisziplinäre Teams, bestehend aus Medizinern, IT-Spezialisten und Datenschutzexperten, gewährleisten, dass technische Innovationen sowohl den medizinischen Anforderungen als auch den gesetzlichen Vorgaben entsprechen.
Fazit: Das Potenzial der KI für vernetzte Gesundheitssysteme
Die vorgestellten Technologien und Fallstudien verdeutlichen eines: Künstliche Intelligenz kann die Interoperabilität im deutschen Gesundheitswesen grundlegend verändern. Sie hat die Fähigkeit, Datensilos zu überwinden, verschiedene Systeme miteinander zu verbinden und einen reibungslosen Informationsaustausch zu ermöglichen.
Bereits heute zeigt sich der Nutzen in Bereichen wie der automatisierten Datenintegration, der präzisen semantischen Zuordnung und dem Echtzeit-Datenaustausch, die Ärzten helfen, schneller und genauer zu handeln.
Doch trotz dieser Fortschritte gibt es noch einige Hindernisse. Technisch gesehen stehen veraltete IT-Systeme und fragmentierte Datenbestände einer vollständigen Integration im Weg. Hinzu kommen regulatorische Hürden, wie die Anforderungen der DSGVO oder des Medizinprodukterechts, die eine sorgfältige Planung und Umsetzung erfordern. Auch organisatorische Widerstände in Kliniken und Praxen bremsen die Einführung neuer Technologien.
Dennoch gibt es Lösungen, die vielversprechend sind. Technologien wie Foundation Models, multimodale Datenintegration und Federated Learning bieten Ansätze, um Effizienz und Sicherheit zu verbessern und gleichzeitig Datenschutzprobleme zu reduzieren. Blockchain-Technologien und Edge Computing tragen zusätzlich zur Sicherheit und Schnelligkeit der Datenverarbeitung bei.
Der Schlüssel zum Erfolg liegt in der Zusammenarbeit. Kliniker, Technologieunternehmen, Gesetzgeber und Bildungsexperten müssen gemeinsam an einem Strang ziehen. Nur durch gezielte Schulungen und professionelle Beratung können Gesundheitseinrichtungen die Vorteile der KI vollständig nutzen.
Am Ende wird deutlich: Die digitale Transformation im deutschen Gesundheitswesen hat gerade erst begonnen. Mit den passenden technischen Lösungen, klaren rechtlichen Rahmenbedingungen und einer offenen Haltung gegenüber Innovation kann KI die Grundlage für ein vernetztes, effizientes und patientenorientiertes Gesundheitssystem schaffen.
FAQs
Wie trägt KI dazu bei, IT-Systeme im Gesundheitswesen zu modernisieren und den Datenaustausch zu verbessern?
Künstliche Intelligenz (KI) bietet enormes Potenzial, um IT-Systeme im Gesundheitswesen auf ein neues Niveau zu bringen. Sie erleichtert den Datenaustausch und verbessert die Interoperabilität zwischen verschiedenen Plattformen. Das Ergebnis? Effizientere Verarbeitung und Analyse von Gesundheitsdaten, die wiederum schnellere Diagnosen, individuell angepasste Behandlungen und eine hochwertigere Patientenversorgung ermöglichen.
Ein zentraler Schritt in diesem Prozess ist die Einführung einheitlicher Datenstandards und der Aufbau interoperabler Infrastrukturen. Diese Maßnahmen helfen, fragmentierte Gesundheitsdaten zu bündeln und nutzbar zu machen. Mithilfe von KI können Muster in umfangreichen und komplexen Datensätzen erkannt werden, was die Zusammenarbeit zwischen Ärzten, Krankenhäusern und anderen Akteuren im Gesundheitssystem erheblich vorantreibt. Dabei dürfen jedoch ethische Grundsätze nicht außer Acht gelassen werden – Datenschutz und Datensicherheit müssen stets oberste Priorität haben.
Wie können rechtliche und ethische Herausforderungen bei der Nutzung von KI im Gesundheitswesen bewältigt werden?
Die Nutzung von KI im Gesundheitswesen bringt rechtliche und ethische Herausforderungen mit sich, die gezielte Ansätze erfordern. Transparenz und Nachvollziehbarkeit von KI-Systemen sind entscheidend, damit Entscheidungen klar und verständlich bleiben. Gleichzeitig ist der Schutz von Patientendaten unverzichtbar, ebenso wie die Einhaltung hoher Standards in Bezug auf Qualität und Sicherheit.
Ein weiterer wichtiger Aspekt ist die Interoperabilität – also die Fähigkeit, Gesundheitsdaten reibungslos zwischen verschiedenen Systemen auszutauschen. Um dies zu erreichen, sollten ethische Richtlinien entwickelt werden, die helfen, algorithmische Verzerrungen zu minimieren und Datenschutzfragen klar zu regeln. Darüber hinaus ist es essenziell, sowohl Fachkräfte als auch Patienten in ihren digitalen Fähigkeiten zu stärken, damit KI-Technologien verantwortungsvoll und effektiv genutzt werden können.
Wie können Kliniken und medizinisches Personal effektiv auf den Einsatz von KI vorbereitet werden, um die Interoperabilität im Gesundheitswesen zu verbessern?
Damit Kliniken und medizinisches Personal das volle Potenzial von KI nutzen können, um die Zusammenarbeit im Gesundheitswesen zu verbessern, sind einige wichtige Schritte erforderlich:
- Einheitliche Dateninfrastrukturen aufbauen: Gesundheitsdaten müssen in einem standardisierten und leicht zugänglichen Format vorliegen. Die derzeitige Fragmentierung von Daten stellt eine der größten Hürden dar, die überwunden werden muss, um KI-Systeme effektiv einzusetzen.
- Ethische und rechtliche Rahmenbedingungen klären: Themen wie Datenschutz, Transparenz und der Umgang mit möglichen Verzerrungen in Algorithmen müssen klar definiert werden. Nur so können Vertrauen und Sicherheit im Umgang mit KI gewährleistet werden.
- Standardisierung stärken: Einheitliche Datenformate, Protokolle und Kodierungen sind unverzichtbar, damit unterschiedliche Systeme problemlos miteinander arbeiten können. Ohne klare Standards bleibt ein reibungsloser Datenaustausch schwierig.
- Engere Zusammenarbeit ermöglichen: Eine enge Abstimmung zwischen medizinischem Fachpersonal, Forschern, der Industrie und politischen Entscheidungsträgern ist unerlässlich. Nur durch gemeinsame Anstrengungen können sichere und nachhaltige KI-Lösungen entstehen.
Diese Maßnahmen helfen nicht nur dabei, die Interoperabilität zu verbessern, sondern tragen auch dazu bei, die Gesundheitsversorgung effizienter und stärker auf die Bedürfnisse der Patienten auszurichten.
Verwandte Blogbeiträge
- KI im Gesundheitswesen: 7 praktische Anwendungen
- Daten-Mapping und Transformation mit KI
- KI-gestützte Innovation: Beispiele aus dem Gesundheitswesen
- 5 Wege, wie KI Ärzte zu Führungskräften macht